
| A. | 22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA | |
| B. | 常温下,1L0.5mo1•L-1 FeCl3溶液中含有的Fe3+数目一定小于0.5NA | |
| C. | 12g石墨中含有C-C共价键数为1.5NA | |
| D. | 28g由乙烯和环丁烷(C4H8)组成的混合气体中含有的碳原子数为2NA |
分析 A.没有告诉在标况下,不能使用标况下气体摩尔体积计算;
B.铁离子部分水解,导致铁离子数目减少;
C.根据石墨晶体中一个C与其它三个碳原子形成3个共价键,采用均摊法计算出含有的碳碳键数目;
D.乙烯和环丁烷的最简式均为CH2,根据最简式计算.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算氯气的物质的量,故A错误;
B.常温下,1L0.5mo1•L-1 FeCl3溶液中含有0.5mol氯化铁,由于铁离子部分水解,则溶液中含有的Fe3+数目一定小于0.5NA,故B正确;
C.12g石墨含有的碳原子的物质的量为1mol,每个碳原子与其它碳原子形成了3个碳碳键,每个碳原子形成的共价键为:$\frac{1}{2}$×3=1.5个,所以1molC形成了1.5mol共价键,含C-C共价键数目为1.5NA,故C正确;
D.乙烯和环丁烷的最简式均为CH2,则28g混合物中含2molCH2,含2NA个碳原子,故D正确;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为见到鬼,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
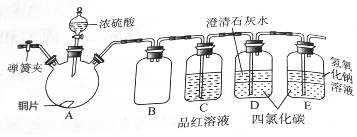 某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).
某研究性学习小组为研究Cu与浓硫酸的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W元素无同位素 | |
| B. | X单质分子中含共价键 | |
| C. | 简单离子半径:Y<Z | |
| D. | W、Y、Z不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列有关仪器的使用正确的是( )
A. 手持试管给试管内的物质加热
B. 用燃着的酒精灯去点燃另一盏酒精灯
C. 用天平称量药品时用手直接拿砝码
D. 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com