
 用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H++2e-=H2↑ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
分析 根据装置图,该电解质溶液呈碱性,电解时,阳极要生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,据此分析.
解答 解:A.根据装置图,该电解质溶液呈碱性,电解时,阳极要生成氯气,所以铁不能作阳极,石墨做阳极,铁做阴极,故A正确;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故B正确;
C.电解质溶液呈碱性,则阴极电极反应式为2H++2e-=H2↑,故C正确;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故D错误;
故选:D.
点评 本题主要考查电解原理,明确各个电极上发生的反应及电解原理是解本题关键,易错选项是D,注意D中碱性条件下不能有氢离子参加反应或生成.


科目:高中化学 来源: 题型:解答题
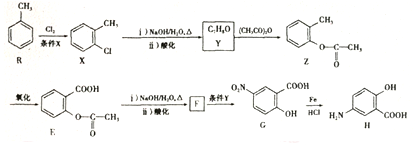
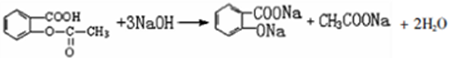 .
.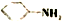 易被氧化;苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,当苯环上连有羧基时则取代在间位.据此以R为原料合成化合物
易被氧化;苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,当苯环上连有羧基时则取代在间位.据此以R为原料合成化合物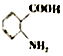 ,参照上述流程设计合成路线:
,参照上述流程设计合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
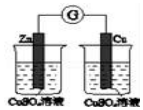 | 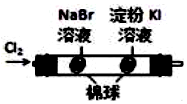 | 将稀盐酸与碳酸钠 溶液混合 | 5%的H2O2溶 液中滴入2滴 1molL-1氯化 铁溶液 |
| 验证化学能 转化为电能 | 验证氧化性Cl2>Br2>I2 | 验证氯比氮的非金属性强 | 验证催化剂加快 反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
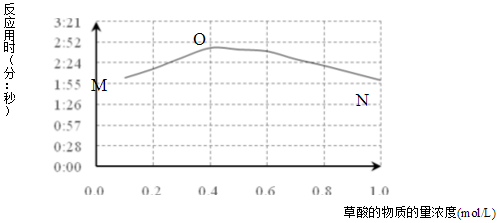
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
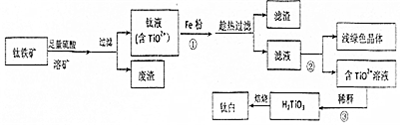
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| B. | 能与金属铝反应放出氢气的溶液中:Fe2+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 含有HCO3-的溶液中:K+、A13+、NO3-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com