
【题目】海洋是资源的宝库,海水中所含食盐高达4×1016t。用海水可生产食盐和金属镁或镁的化合物,其过程如下图所示。

请回答
(1)贝壳主要成分的化学式_________________;
(2)步骤④反应的离子方程式____________________________________________;
(3)实验室由粗盐结晶制精盐的操作包括溶解、过滤、蒸发等步骤,
A.粗盐提纯过程中过滤的目的是____________(填序号)
①获得NaCl晶体 ②除去难溶性物质 ③除去易挥发物质 ④除去可溶性物质
B.过滤需要用到的玻璃仪器有玻璃棒______________、______________。
(4)电解MgCl2制金属Mg的反应方程式为MgCl2![]() Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
Mg+Cl2↑。电解0.2molMgCl2可生成金属Mg_______g,同时可得到氯气__________L(标准状况)。
【答案】CaCO3Mg(OH)2+2H+=Mg2++2H2O②漏斗烧杯4.84.48
【解析】
(1)根据贝壳的主要成分是碳酸钙;
(2)根据对应步骤写出对应的离子方程式;
(3)A.粗盐提纯过程中过滤的目的是除去沉淀;B.过滤需要用到的玻璃仪器有玻璃棒、漏斗、烧杯;
(4)根据MgCl2![]() Mg+Cl2↑进行计算。
Mg+Cl2↑进行计算。
(1)根据贝壳的主要成分是碳酸钙,
故答案为:CaCO3;
(2)因反应①是Mg(OH)2与盐酸反应:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)A.粗盐提纯过程中过滤的目的是除去沉淀,
故选:②;
B.过滤需要用到的玻璃仪器有玻璃棒、漏斗、烧杯,
故答案为:漏斗;烧杯;
(4)由MgCl2![]() Mg+Cl2↑可知电解0.2molMgCl2生成0.2mol金属Mg、0.2mol氯气,金属Mg的质量为0.2mol×24g/mol=4.8g,氯气的体积为0.2mol×22.4L/mol=4.48L,
Mg+Cl2↑可知电解0.2molMgCl2生成0.2mol金属Mg、0.2mol氯气,金属Mg的质量为0.2mol×24g/mol=4.8g,氯气的体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.8;4.48。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是 ( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①③⑤ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个OH的物质的量为________mol,含有质子的物质的量为_____mol,含有电子的物质的量为________mol,这些OH和________g Na+含有的电子数相同。
(2)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol1。若阿伏加德罗常数用NA表示。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体在标准状况下的密度为___________ g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量氯水加入盛有KI溶液的试管中,加入适量的CCl4 , 然后振荡,静置,产生的现象是( )
A.溶液分层,上层几乎无色,下层紫红色
B.溶液分层,上层紫红色,上层几乎无色
C.溶液分层,上层几乎无色,下层橙红色
D.溶液呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:

(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2(g) + O2(g)![]() 2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
2SO3(g) ,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为_________,用O2浓度变化来表示的反应速率为_________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是_________;
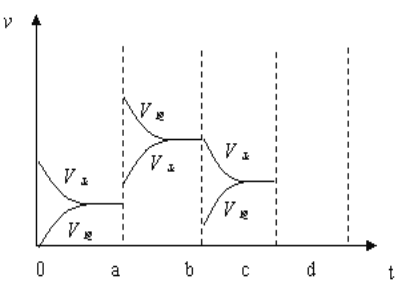
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将_______(容器不与外界进行热交换,填“升高”或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com