
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
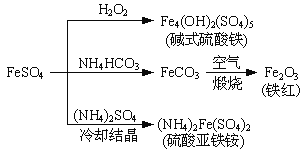
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中错误的是

A. 此过程中铁被腐蚀
B. 此过程中电子从Fe移向Cu
C. 正极电极反应式为:2H++2e-===H2↑
D. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市为了减少燃煤造成的大气污染,对于作民用燃料的煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。
①该反应中的氧化剂是________,若有1 mol FeS2被除去,则发生转移的电子的物质的量是________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新利用生成FeCl3。请写出这一过程中有关的离子方程式:_____________。
(2)另一种方法是采用“固硫法”,即在燃料中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______、________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,请写出其燃烧的化学方程式:_____________。
(4)绿色能源是人类的理想能源,不会造成环境污染,下列能源属于绿色能源的是________。
A 氢能源 B 太阳能 C 风能 D 石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. NH4Cl的水解常数表达式:K=![]()
B. NaHCO3水解的离子方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知: ,
,![]() R-COOH
R-COOH
(1)A的名称是_____________;B中含氧官能团名称是________________。
(2)C的结构简式________________;D→E的反应类型为________________
(3)E→F的化学方程式为___________________________。
(4)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是__________________(写出结构简式)。
(5)等物质的量的 分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验
分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验 其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:
,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:

(1)![]() 的电子式为__________。“碱浸”的目的是____________。
的电子式为__________。“碱浸”的目的是____________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
(3)“萃取净化”除去的杂质离子除![]() 外,还有________(填离子符号)
外,还有________(填离子符号)
(4)“苯取分离“中钴、锂的萃取率与平衡时溶液![]() 的关系如图所示,
的关系如图所示,![]() 一般选择5左右,理由是_____________________________________。
一般选择5左右,理由是_____________________________________。

(5)“沉锂“中![]() 的溶解度随温度变化的曲线如图所示:
的溶解度随温度变化的曲线如图所示:
①根据平衡原理分析![]() 在水中的溶解度随温度变化的原因______________。
在水中的溶解度随温度变化的原因______________。
②为获得高纯![]() ,提纯操作依次为热过滤、_______、烘干。
,提纯操作依次为热过滤、_______、烘干。
③若“沉锂”中![]() ,加入等体积等浓度
,加入等体积等浓度![]() 溶液,则此时沉锂率为________________。(已知
溶液,则此时沉锂率为________________。(已知![]() 的
的![]() 为
为![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com