
| A、νA=2mol/L?min (正反应速率);νA=2mol/L?min(逆反应速率) |
| B、νA=2mol/L?min(正反应速率);νC=2mol/L?min(逆反应速率) |
| C、νA=1mol/L?min (正反应速率);νB=2mol/L?min(逆反应速率) |
| D、νA=1mol/L?min(正反应速率);νC=1.5mol/L?min(逆反应速率) |


科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电子流入储氢合金电极 |
| B、放电时1molLaNi5H6失去6mol电子 |
| C、放电时正极反应为NiOOH+H2O-e-=Ni(OH)2+OH- |
| D、充电时外接电源的正极应该接在储氢合金的电极上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下用PH计测定浓度为0.1mol?L-1NaClO溶液和0.1mol?L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| D | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钠保存在煤油里 |
| B、氯水保存在无色透明的试剂瓶中 |
| C、工业上采用电解熔融MgO的方法制备金属Mg |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、Al3+、CO32-、Cl- |
| B、Cu2+、NO3-、H+、Cl- |
| C、Na+、OH-、SO42-、HCO3- |
| D、K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝和氧化铁用镁带引燃 |
| B、氯气和氢气混合后与光发生爆炸 |
| C、工业上用焦炭制水煤气 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
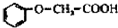 )发生化
)发生化查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com