
����Ŀ��Ϊ���Ʊ�������ijͬѧ�������Ϸ���ʵ�����ﳣ��Ũ������������̷�Ӧ����ȡ��������������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��1������˫���ŷ��Ը÷�Ӧ���б�ע_________________________________��
��2��д���÷�Ӧ�����ӷ���ʽ________________��
��3����ͬѧ��43.5g MnO2�������� HCl��Ũ����Ӧ�����Ʊ�����µ����������Ϊ_______ L,��Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ_______mol����Ӧ�б�������HCl���ʵ���Ϊ_______mol��
��4����ʵ������,������ͼ�е�װ�þ�������,��ƿ�٢���Ӧʢ�ŵ��Լ��ֱ��Ǣ�____,��_____�����Լ�����)��
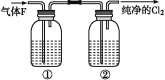
���𰸡�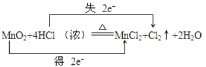 MnO2+4H++2Cl-
MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O 11.2 1 1 ����ʳ��ˮ Ũ����
Mn2++Cl2��+2H2O 11.2 1 1 ����ʳ��ˮ Ũ����
��������
(1)��ӦMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O�У�MnԪ�ػ��ϼ۽��ͣ�����ԭ��MnO2Ϊ��������ClԪ�ػ��ϼ����ߣ���������HClΪ��ԭ����Cl2Ϊ�������MnCl2Ϊ��ԭ�����Ԫ�ػ��ϼ۱仯��֪ת�Ƶĵ�����ĿΪ2����˫���ŷ���ʾ������ԭ��Ӧ�ֵ���ת�����Ϊ
MnCl2+Cl2��+2H2O�У�MnԪ�ػ��ϼ۽��ͣ�����ԭ��MnO2Ϊ��������ClԪ�ػ��ϼ����ߣ���������HClΪ��ԭ����Cl2Ϊ�������MnCl2Ϊ��ԭ�����Ԫ�ػ��ϼ۱仯��֪ת�Ƶĵ�����ĿΪ2����˫���ŷ���ʾ������ԭ��Ӧ�ֵ���ת�����Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)��Ӧ��MnO2��H2OΪ�����Cl2Ϊ���ʣ����������ӷ���ʽΪMnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl-
Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(3)���ݹ�ʽ![]() �ɵã�43.5gMnO2�����ʵ���Ϊ0.5mol���ٽ�ϻ�ѧ��Ӧ����ʽ�����ʵ����뻯ѧ�����������ȣ�������2molHCl������0.5mol��������������Ϊ11.2L����Ӧ��ת�Ƶĵ��ӵ����ʵ���=0.5mol��2=1mol������2molHCl����1molHCl���������ʴ�Ϊ��11.2��1��1��
�ɵã�43.5gMnO2�����ʵ���Ϊ0.5mol���ٽ�ϻ�ѧ��Ӧ����ʽ�����ʵ����뻯ѧ�����������ȣ�������2molHCl������0.5mol��������������Ϊ11.2L����Ӧ��ת�Ƶĵ��ӵ����ʵ���=0.5mol��2=1mol������2molHCl����1molHCl���������ʴ�Ϊ��11.2��1��1��
(4)Ũ������MnO2��Ӧ��ȡCl2����Ӧ��Ҫ���ȣ�HCl�ӷ���ͬʱ����ˮ����Ҫ�ñ���ʳ��ˮ����ȥ�ӷ���HCl������Ũ������и���ʴ�Ϊ������ʳ��ˮ��Ũ���ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ�Ļ���ԭ�ϣ���������ԭ������������ȥ�ȼ��ȡ��ش��������⣺
(1)Ҫ����250mL0.5mol/L��Na2SO3��Һ����Ҫ��������ƽ��ȡNa2SO3��7H2O����________g��������Һ���õ��IJ��������У����������ձ�����Ͳ��_________________��
(2)���ƹ�������������ˮ����С���ȴ�����ʹ�ã��������ˮ��Ŀ����________��
(3)���в�����ʹ������ҺŨ��ƫ�ߵ���________��
A.��ѡ�õ������Ѿ�ʧȥ���ֽᾧˮ B.�������ƾ���������λ�÷ŷ���
C.ת����Һʱ���������ڿ̶����Ϸ� D.����ʱ��������ƿ�Ŀ̶���
E.ҡ�Ⱥ���Һ���ڿ̶��ߣ��ټ�������ˮʹҺ����͵���̶�������
(4)Na2SO3���ڿ��������ױ��������ʡ�����Na2SO3��Һ�Ƿ���ʵķ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���AΪԭ�Ϻϳɾۺ���PMA�;�̼����PC��·�����£�
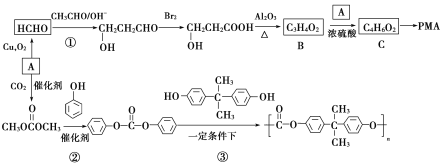
�ش��������⣺
(1)���й��ڸ߷��ӻ������˵������ȷ����________�������ţ�
a.����ϩ�����к���̼̼˫��
b.![]() �ĵ�����2-��Ȳ
�ĵ�����2-��Ȳ
c.������ë�Ͳ�˿����Ȼ��ά
d.CuSO4��Һ��ʹ�����ʱ���
(2)A�Ļ�ѧ������________��C�еĹ���������Ϊ_________��
(3)�ٵķ�Ӧ����Ϊ________���۵ķ�Ӧ����Ϊ________��
(4)��Ӧ�ڵĻ�ѧ����ʽΪ_____________________��
(5)B��ͬϵ��C5H8O2����____________��ͬ���칹�壨���������칹����д�����к˴Ź�������Ϊ���������ʵĽṹ��ʽ��______________��
(6)���������ϳ�·�ߣ���CH3CHOΪԭ��(���Լ���ѡ)������Ʊ�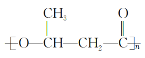 �ĺϳ�·��________________��
�ĺϳ�·��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫұ��ҵ�г��������̡������������Լ���Щ�����ĺ�ɫ�����Ͻ����⣬�����Ľ�������������ɫ������
![]() ��̬��ԭ�ӵĽṹʾ��ͼΪ________����̬��ԭ�ӵļ۲�����Ų�ʽΪ________��
��̬��ԭ�ӵĽṹʾ��ͼΪ________����̬��ԭ�ӵļ۲�����Ų�ʽΪ________��
![]() ��C��N�ĵ縺�Թ�ϵΪC________
��C��N�ĵ縺�Թ�ϵΪC________![]() ����
����![]() ������
������![]() ��
��![]() ��
��![]() �ķе��
�ķе��![]() �ķе�ͣ���ԭ����________��
�ķе�ͣ���ԭ����________��
![]() ��Cԭ�ӵ��ӻ���ʽΪ________��
��Cԭ�ӵ��ӻ���ʽΪ________��![]() ������________
������________![]() ���������������Ǽ�����
���������������Ǽ�����![]() ���ӣ�
���ӣ�![]() ������
������![]() ����
����![]() ������Ŀ֮��Ϊ________��
������Ŀ֮��Ϊ________��
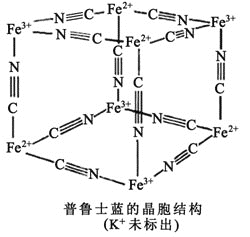
![]() �����̵�һ�־���Ϊ�����������ܶѻ����侧������________����ԭ�ӣ�ÿ����ԭ����Χ���ڵ���ԭ����________����
�����̵�һ�־���Ϊ�����������ܶѻ����侧������________����ԭ�ӣ�ÿ����ԭ����Χ���ڵ���ԭ����________����
![]() ��
��![]() ��
��![]() ��Χ�н϶���������Ŀչ����������һЩ���ӻ������γ�������ͼΪ��³ʿ������ᄃ��ṹ��ʾ��ͼ
��Χ�н϶���������Ŀչ����������һЩ���ӻ������γ�������ͼΪ��³ʿ������ᄃ��ṹ��ʾ��ͼ![]() ÿ�����������У�һ��
ÿ�����������У�һ��![]() ������һ�����������ģ���һ������
������һ�����������ģ���һ������![]() ���仯ѧʽ��________��
���仯ѧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
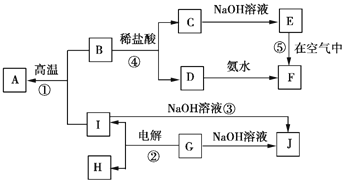
����Ŀ��![]() �ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮������ϵ��ͼ��ʾ
�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮������ϵ��ͼ��ʾ![]() ���ַ�Ӧ�������û���г�
���ַ�Ӧ�������û���г�![]() ����A��B��C��D��E��F���������о���ͬһ��Ԫ�أ�
����A��B��C��D��E��F���������о���ͬһ��Ԫ�أ�
����д���пհף�
![]() ��B��C��D��E��F����������������ͬһ��Ԫ�������ڱ��е�λ��Ϊ ______ ��
��B��C��D��E��F����������������ͬһ��Ԫ�������ڱ��е�λ��Ϊ ______ ��
![]() ��Ӧ
��Ӧ![]() �����ĵ缫��ӦʽΪ ______ ����Ӧ
�����ĵ缫��ӦʽΪ ______ ����Ӧ![]() �����ӷ���ʽΪ ______ ����Ӧ
�����ӷ���ʽΪ ______ ����Ӧ![]() �Ļ�ѧ����ʽΪ ______ ��
�Ļ�ѧ����ʽΪ ______ ��
![]() ʵ��������C��Һʱͨ��Ҫ���������� ______ ��������D��Ũ��Һ�����ˮ�еõ���Һ��� ______ ɫ������εμ�����ʱ�������������� ______ ��
ʵ��������C��Һʱͨ��Ҫ���������� ______ ��������D��Ũ��Һ�����ˮ�еõ���Һ��� ______ ɫ������εμ�����ʱ�������������� ______ ��
![]() ��Ӧ
��Ӧ![]() ��ÿ����3molA��ת�Ƶ��ӵ����ʵ���Ϊ ______ ��
��ÿ����3molA��ת�Ƶ��ӵ����ʵ���Ϊ ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ�BaCl22H2O���������£�
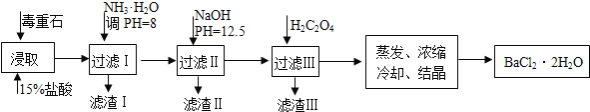
��1������ʯ�������ȡǰ������ĥ��Ŀ����____________________��ʵ������37%����������15%�����ᣬ����Ͳ���ʹ�����������е�______________��
a���ձ� b������ƿ c�������� d���ζ���
��2������NH3H2O����pH=8�ɳ�ȥ_____�������ӷ��ţ����������к�______���ѧʽ��������H2C2O4ʱӦ���������ԭ����_________________��
��֪��Ksp��BaC2O4��=1.6��10��7��Ksp��CaC2O4��=2.3��10��9
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ��pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ��pH | 13.9 | 11.1 | 3.2 |
��3�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42��+2H+�TCr2O72��+H2O Ba2++CrO42���TBaCrO4��
�������ȡx mlһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμӵ��������ΪV0 mL��
�������ȡy mLBaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ���������ΪV1 mL��
�μ������ҺʱӦʹ����ʽ�ζ��ܣ���0���̶�λ�ڵζ��ܵ�______________����Ϸ������·�������BaCl2��Һ��Ũ��Ϊ______________ molL-1����������еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ��______________���ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
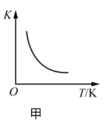
����Ŀ����������ͼʾ���ó��Ľ�����ȷ����
A.ͼ�ױ�ʾ��Ӧ![]() ��ƽ�ⳣ��K���¶ȵĹ�ϵ��˵���÷�Ӧ��
��ƽ�ⳣ��K���¶ȵĹ�ϵ��˵���÷�Ӧ��![]()
B.ͼ�ұ�ʾCu�����Ũ���ᷴӦ���ɵ�![]() ���������ʱ��ı仯��ϵ��˵���÷�Ӧ��
���������ʱ��ı仯��ϵ��˵���÷�Ӧ��![]() ʱ����ڷ�Ӧ�������
ʱ����ڷ�Ӧ�������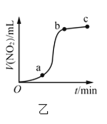
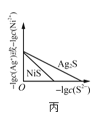
C.ͼ����ʾһ���¶���![]() ��NiS�ij����ܽ�ƽ�����ߣ�˵�����¶��£�
��NiS�ij����ܽ�ƽ�����ߣ�˵�����¶��£�![]() ʱ�����ߵ�
ʱ�����ߵ�![]() ���
���
D.ͼ����ʾ��ͬ�¶��£�![]() ��HF��
��HF��![]() ��Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ�˵����ˮϡ��ǰHF�ĵ���̶ȴ���
��Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ�˵����ˮϡ��ǰHF�ĵ���̶ȴ���![]() �ĵ���̶�
�ĵ���̶�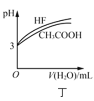
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���������ʵ�飺
�ٽ�0.1mol��L-1MgCl2��Һ��0.5mol��L-1NaOH��Һ�������ϵõ���Һ
��ȡ����������Һ���μ�0.1mol��L-1FeCl3��Һ�����ֺ��ɫ����
�۽�������Һ���ˣ�ȡ������ɫ�������μ�0.1mol��L-1FeCl3��Һ����ɫ������Ϊ���ɫ����
����ȡ������ɫ�������μӱ���NH4Cl��Һ�������ܽ�
����˵���в���ȷ���ǣ� ��
A.������������Һ���ˣ�������Һ�к�����Mg2+
B.������Һ�д��ڳ����ܽ�ƽ�⣺Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C.ʵ��ں͢۾���˵��Fe(OH)3��Mg(OH)2����
D.NH4Cl��Һ�е�NH![]() �����Ǣ��г����ܽ��ԭ��
�����Ǣ��г����ܽ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȼ�ռ�����Ŀǰ��Դ�����о����ȵ�֮һ����NiO��������Ļ�ѧ��ȼ��ʾ��ͼ������Ȼ�ѧ��Ӧ���£�
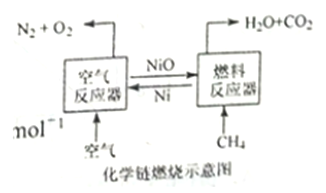
2Ni(s)+O2(g)=2NiO(s)��H=-479.8 kJ��mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)��H=akJ��mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)��H=b kJ��mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)��H=156.9 kJ��mol-1
����˵��������ǣ� ��
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) ��H=(2a-b) kJ��mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H=-802.7 kJ��mol-1
C. ��������ȼ�Ϸ�Ӧ�����з�Ӧʱ��������ɫ���沢�ų�����
D. ��̼ȼ����������ѧ��ȼ�ռ����������ڶ�����̼�ķ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com