
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是( )
A.X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反
B.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.Z的氢化物比X的氢化物更稳定
【知识点】原子结构 元素周期律 E1 E2
【答案解析】D 解析:短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14,X与Y、Z位于相邻周期,则Y和Z位于同一周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍,原子最外层电子数不超过8,所以X内层为K层,K层电子数是2,所以Z最外层电子数是6,Y最外层电子数是3,X、Y、Z最外层电子数之和为14,所以X最外层电子数=14-6-3=5,所以X核外电子数是7,为N元素;N元素位于第二周期,Y和Z位于第三周期,Y的最外层电子数是3、Z原子最外层电子数是6,所以Y是Al、Z是S元素,
A.X的氢化物是NH3,X的最高价氧化物的水化物是HNO3,氨水溶液呈碱性、硝酸溶液呈酸性,故A正确;
B.Y的氧化物是Al2O3,氧化铝既可与强酸反应又可与强碱反应,属于两性氧化物,氧化铝熔点很高,所以并可用来制作耐火材料,故B正确;
C.X和Z的最高价氧化物对应的水化物分别是HNO3、H2SO4,浓硝酸和浓硫酸都是强氧化性酸,故C正确;
D.非金属性N>S,所以X的氢化物比Z的氢化物更稳定,故D错误;故答案选D
【思路点拨】本题考查了原子结构和元素周期律的关系,根据原子结构正确推断元素是解本题关键,再结合元素周期律来分析解答。


科目:高中化学 来源: 题型:
、室温下,在0.2mol/L Al2(SO4)3溶液中,逐滴加入1.0mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3+ + 3OH- Al(OH)3
Al(OH)3
B.a-b段,溶液pH增大,Al3+浓度不变
C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
(甲) XO3n-+Xn- + H+ →X单质+ H2O(未配平); (乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③ B. ②③ C. ①② D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
酒精、乙酸和葡萄糖三种溶液,只用一种试剂就能将它们区别开来,该试剂是( )
A.金属钠 B.石蕊试液
C.新制的氢氧化铜悬浊液 D.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法合理的是
A.若X+ 和Y2 - 的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCI>H2S,可推断出元素的非金属性:CI>S
C.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键
D.H—F、H—O、H—N三种共价键的极性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 B、C、D、E五种短周期元素,元素A最外层电子数与其周期数相等,A与C可形成A2C2和A2C两种化合物,B的最高价氧化物对应的水化物与气体BA3化合生成乙,D+与C2-具有相同的电子数,E元素最高化合价与最低化合价代数和为6。
请回答下列问题:
(1) C在元素周期表中的位置为____________。写出BA3的电子式_______________。
(2)上述元素中,原子半径最大的是____________________(写元素符号)。最高价氧化物对应的水化物中酸性最强的酸是__________________(写化学式)。
(3)化合物乙的水溶液呈酸性,请用离子方程式表示__________________。
(4) A、C、E三种元素按原子个数比1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应不同的元素。
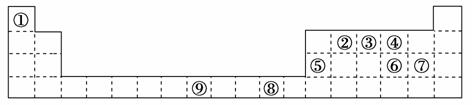
请回答下列问题:
(1)表中属于d区的元素是________(填编号);元素⑧的原子价电子排布式是____________。
(2)③和⑦形成的常见化合物的晶体类型是________;②③④的电负性:________>________>________(用元素符号表示)。判断依据是_________________________________________________________________。
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的________(填编号);该元素与元素①形成的化合物X极易溶于水的原因是__________________________________________________________________
_________________________________________________________________。
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为________,其熔点比金刚石的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:__________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)______,理由是___________________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“是”或“否”)______,理由是________________________________________。
(4)根据上述实验数据,列出计算NaOH纯度的表达式
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com