
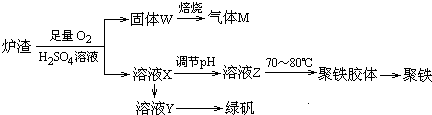
分析 (1)硫铁矿的主要成分为FeS2,其中硫元素化合价为-1价;
(2)硫酸的用途广泛,化肥、医药、农药的生产,金属矿石的处理,金属材料的表面清洗等都要用到硫酸;
(3)化学平衡的适用范围是可逆反应,在工业接触法制硫酸2SO2+O2?2SO3为可逆反应,化学平衡移动的条件有:浓度、温度、压强.催化剂V2O5的作用是提高反应速率,温度控制在450℃左右,是根据使催化剂的活性最强确定,压强采用常压.因此根据化学平衡移动原理来确定的条件只有浓度;
(4)转化率:可逆反应到达平衡时,某反应物的转化浓度(等于某反应物的起始浓度和平衡浓度的差)与该反应物的起始浓度比值的百分比.可用以表示可逆反应进行的程度;
(5)沸腾炉中,黄铁矿从顶部加入,空气从底部通入,形成对流;接触室中热交换器内部温度高的气体和外部温度低的气体形成热量对流;吸收塔的气体底部进入,从下向上运动,冷的浓硫酸从吸收塔顶部喷洒,从上向下运动,形成流动,进行热量交换;
(6)分析流程可知炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,溶液X为含有Fe3+离子的溶液,调节溶液PH得到溶液Z加热得到聚铁,溶液X中加入铁反应生成硫酸亚铁溶液Y,蒸发结晶得到硫酸亚铁晶体
A、炉渣中FeS与硫酸和氧气反应生成硫单质硫酸铁和水;
B、固体W灼烧得到气体为二氧化硫;
C、溶液X中加入过量铁粉,铁和硫酸铁溶液反应生成硫酸亚铁,通过蒸发浓缩,冷却结晶,过滤析出得到绿矾;
D、若溶液Z的PH偏小,则聚铁中生成的氢氧根的含量减少,使铁的含量减少.
解答 解:(1)硫铁矿的主要成分为FeS2,其中铁元素化合价为+2价,则依据元素化合价代数和为0得到硫元素化合价为-1价,
故答案为:-1;
(2)用硫酸制造的常见化肥有硫酸铵、硫酸氢铵、硫酸锌、硫酸钾等化肥,
故答案为:硫酸铵或硫酸氢铵或硫酸锌或硫酸钾;
(3)硫酸生产中,第二步:SO3的制取反应原理为:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的.
A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 反应速率,而不是从2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 反应中化学平衡角度考虑,故A不正确;
B.使用V2O5作催化剂,催化2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;
C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,故C不正确;
D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;
E.接触室中:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;
F.吸收塔中用98.3%的浓硫酸吸收SO3,主要目的是防止产生酸雾,阻碍SO3的吸收,与化学平衡移动原理无关,故F不正确;
故答案为:D;
(4)设二氧化硫的初始浓度为a,则第一次转化掉的二氧化硫浓度为a×95%,剩余的二氧化硫浓度为a×(1-95%),进入第二次转化,则第二次转化掉的二氧化硫浓度为a×(1-95%)×95%
根据公式:转化率═$\frac{消耗量}{起始量}$×100%
最终SO2的转化率═$\frac{a×95%+a(1-95%)×95%}{a}$×100%═99.75%
故答案为:99.75%;
(5)①从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动,从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换,
故答案为:从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动;从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换;
②工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理.
先用氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的.
故答案为:SO2+2NH3•H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O;
(6)分析流程可知炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,溶液X为含有Fe3+离子的溶液,调节溶液PH得到溶液Z加热得到聚铁,溶液X中加入铁反应生成硫酸亚铁溶液Y,蒸发结晶得到硫酸亚铁晶体
A、炉渣中FeS与硫酸和氧气反应生成硫单质硫酸铁和水,反应的离子方程式为4FeS+3O2+12H+═4Fe3++4S↓+6H2O,故A正确;
B、炉渣加入硫酸溶液同时通入氧气得到固体W为氧化还原反应生成的硫单质和SiO2等,固体W灼烧得到气体为二氧化硫,通入双氧水得到硫酸,故B正确;
C、溶液X中加入过量铁粉,铁和硫酸铁溶液反应生成硫酸亚铁,通过蒸发浓缩,冷却结晶,过滤析出得到绿矾,符合晶体析出步骤,故C正确;
D、用pH试纸测定方法为:将试纸放在表面皿上,用洁净的玻璃棒蘸取待测液,点在试纸的中央,然后与标准比色卡对比.氢氧化铁的含量比硫酸亚铁高,若溶液Z的PH偏小,则聚铁中生成的氢氧根的含量减少,使铁的含量减少,故D错误;
故答案为:ABC.
点评 本题考查的知识点多,主要是工业接触法制硫酸的原理、反应速率、转化率、反应的热效应、工业尾气的处理、化学方程式书写等,只有掌握相关的基础知识,解题并不困难,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. 、
、 、
、 、
、 任意1种.
任意1种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
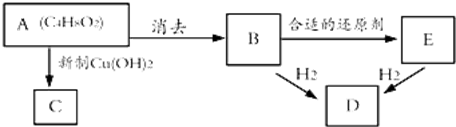
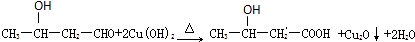 .
.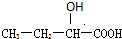 、
、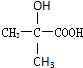 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com