
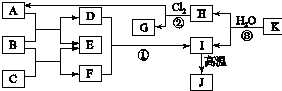
 如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).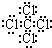 ,故答案为:Al;第三周期第IIIA族;
,故答案为:Al;第三周期第IIIA族;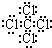 ;
; ,
, ;
;

 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| 淀粉-KI试纸检验气体 | 集气瓶收集氨气 | 容量瓶 |
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 烧杯、玻璃棒、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )与苯炔(
)与苯炔( )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
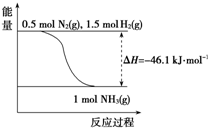
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时1g镁投入100ml 0.5mol/L盐酸溶液中 |
| B、25℃时1g镁投入200ml 0.5mol/L盐酸溶液中 |
| C、25℃时1g镁投入50ml 1mol/L盐酸溶液中 |
| D、50℃时1g镁投入10ml 1mol/L盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、980 ml,114.7g |
| B、500ml,58.5g |
| C、1000 ml,117 g |
| D、1000ml,117.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com