
| A. | 10% | B. | 20% | C. | 50% | D. | 80% |
分析 硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,再根据$\overline{M}$=$\frac{m}{n}$计算其物质的量之比,利用物质的量计算物质的量分数.
解答 解:硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\frac{10g/mol×xmol+11g/mol×ymol}{(x+y)mol}$=10.8g/mol,
解得x:y=1:4,设10B和11B的物质的量分别是1mol、4mol,
则对105B的原子百分比是$\frac{1mol}{1mol+4mol}$×100=20%,
故选B.
点评 本题考查物质的量的计算,为高频考点,把握元素的平均摩尔质量及物质的量比等于原子个数比为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
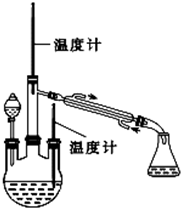 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸的导电能力一定大于醋酸 | |
| B. | 在氨水中加入无水醋酸,溶液的导电能力基本不变 | |
| C. | 在氢氧化钡的稀溶液中,c(OH-)=2c(Ba2+) | |
| D. | 在磷酸的稀溶液中,c(H+)=3c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
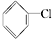 ②
②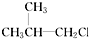 ③(CH3)3CCH2Cl ④CHCl2CHBr2⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2⑤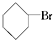 ⑥CH3Cl.
⑥CH3Cl.| A. | 全部 | B. | ②③⑤ | C. | ①③⑥ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
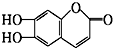 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | M的相对分子质量是178 | |
| B. | 1mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的分子式为C9H4O5Na4 | |
| D. | 1mol M与足量碳酸氢钠反应能生成2mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CH3CH2CHO | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
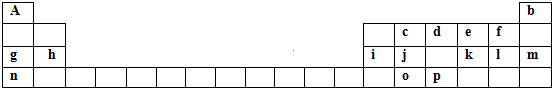
 ,画出k元素的离子结构示意图
,画出k元素的离子结构示意图
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| B. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O c(NH4+)由大到小的顺序是:②>①>③ | |
| C. | 0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合(忽略混合时体积变化):c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com