
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
分析 A.电池中的重金属离子污染土壤和水源;
B.反应自发进行的判断依据为△G=△H-T•△S;
C.太阳能、风能和氢能是洁净能源;
D.可燃冰(固态甲烷水合物)可作燃料.
解答 解:A.为防止电池中的重金属离子污染土壤和水源,废电池要集中处理,不能深埋,故A错误;
B.反应能否自发取决于焓变和熵变的复合判据,对于吸热反应,在一定温度下也能进行,故B错误;
C.开发太阳能、风能和氢能等洁净能源可减少化石燃料的使用,减少污染物的排放,故C正确;
D.可燃冰(固态甲烷水合物)可作燃料,合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺,但这不是缓解能源紧缺的唯一途径,开发氢能、地热能、风能等都有助于缓解能源紧缺,故D错误.
故选C.
点评 本题考查了化学知识在生活实际的应用,熟悉能源问题、废旧电池回收等即可解答,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
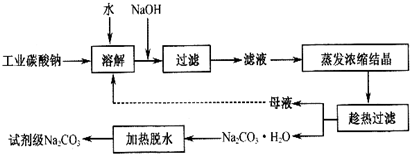
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com