
【题目】维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 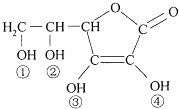
A.维生素C由于含有C═O键而能发生银镜反应
B.维生素C由于含有酯基而难溶于水
C.维生素C的分子式为C6H8O6
D.维生素C的酸性可能是①、②两个羟基引起的
科目:高中化学 来源: 题型:
【题目】为了鉴定卤代烃中所含有的卤素原子,现有下列实验操作步骤.正确的顺序是( ) ①加入AgNO3 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol/L NaOH溶液 ⑤加入5mL 4mol/L HNO3溶液.
A.②④③①
B.②④③⑤①
C.②⑤③①④
D.②⑤①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。某实验小组以如图所示的装置和试剂,通过反应制备亚硝酸钠 (部分夹持装置略)。
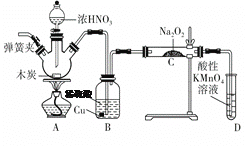
已知:室温下,①2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+。
完成下列填空:
(1)写出A中三种主要玻璃仪器的名称 __________ ,___________,_________。
(2)写出浓硝酸与木炭反应的化学方程式:_______________________。
(3)B中观察到的主要现象是有无色气体产生和______________,D装置的作用是___________________________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置,则该装置中盛放的药品名称是________。
(5)若NO2可以全部转化成NO,将1.56 g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
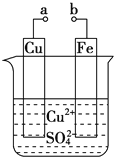
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b用导线连接时,Fe片上发生还原反应,溶液中SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
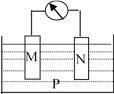
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是 .
(2)用式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20molL﹣1的标准盐酸滴定待测液,判断滴定终点的现象是: .
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是(填答案字母序号)
A.c(Na+)>c(Cl﹣)>c(H+)>c(OH﹣)
B.c(Na+)>c(OH﹣)>c(Cl﹣)>c(H+)
C.c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)
D.c(Cl﹣)+c(Na+)>c(OH﹣)+c(H+)
(5)根据下列数据计算,c(NaOH) mol/L
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com