
【题目】已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:

(1)①装置A中发生反应的离子方程式是_________________。
②整套实验装置存在一处明显的不足,请指出________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后_______________。(填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后______。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因____。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加________溶液,若溶液颜色______________。则上述解释是合理的。
小组同学另查得资料如下:
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因___________、___________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 缺少尾气处理装置 关闭活塞a,点燃酒精灯 CCl4层由无色变为橙色 过量氯气和SCN–反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-Fe(SCN)3 平衡逆向移动而褪色 KSCN溶液(或FeCl3溶液) 变红色(不变红) BrCl + H2O=HBrO + H++Cl- Ag++Cl-=AgCl↓
Mn2++Cl2↑+2H2O 缺少尾气处理装置 关闭活塞a,点燃酒精灯 CCl4层由无色变为橙色 过量氯气和SCN–反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-Fe(SCN)3 平衡逆向移动而褪色 KSCN溶液(或FeCl3溶液) 变红色(不变红) BrCl + H2O=HBrO + H++Cl- Ag++Cl-=AgCl↓
【解析】
(1)①装置A中MnO2与浓盐酸共热制取Cl2,发生反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②氯气有毒,会污染大气,整套实验装置存在的明显不足是没有进行尾气处理。
(2)打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯使MnO2与浓盐酸反应制取氯气。根据实验结论,Cl2通入FeBr2溶液中Cl2先与Fe2+反应,一段时间后Cl2与Br-发生反应Cl2+2Br-=Br2+2Cl-,因Br2易溶解于有机溶剂,故E装置中通入Cl2后可观察到水层溶液变黄,振荡后,下层CCl4层无明显变化。一段时间后CCl4层由无色变为橙色。
(3)①根据资料i,D装置中溶液变红的原因是:Cl2将Fe2+氧化成Fe3+,Fe3+与SCN-发生可逆反应Fe3++3SCN-Fe(SCN)3,结合资料ii,Cl2过量时D中溶液红色褪去的原因是:过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-Fe(SCN)3平衡逆向移动而褪色;要证明上述解释合理只要证明溶液中存在Fe3+就可以了,因此取少量褪色后的溶液,滴加过量的KSCN溶液,溶液重新变红色就可证明。
②根据资料iii,用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,红色物质为BrCl,它与水能发生水解反应,且该反应为非氧化还原反应,红色物质中加入AgNO3溶液,结果观察到仅有白色沉淀产生,结合资料iv,上述过程仅产生白色沉淀的原因是:BrCl + H2O=HBrO + H++Cl- 、Ag++Cl-=AgCl↓。


科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、________、________可制得精盐。(填具体操作名称)
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
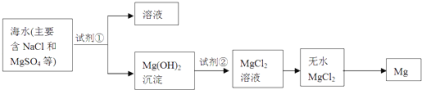
①为了使MgSO4转化为Mg(OH)2 , 试剂①可以选用________。
②试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是________。
A.Mg(OH)![]() MgO
MgO![]() Mg B.Mg(OH)
Mg B.Mg(OH)![]() MgO
MgO![]() Mg
Mg
C.Mg(OH)2![]() MgCl2
MgCl2![]() Mg D.Mg(OH)2
Mg D.Mg(OH)2![]() MgCl2
MgCl2![]() Mg
Mg
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

①A装置中通入a气体的目的是(用离子方程式表示)______________________________;
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是___________;
③反应过程中,B装置中有SO42﹣生成,检验SO42﹣的方法是____________________________;
④C装置的作用是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法不正确的是( )
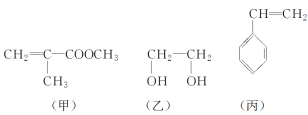
A.甲物质在一定条件下可以生成有机高分子化合物
B.1mol乙物质可与2mol钠完全反应生成2mol氢气
C.甲、乙、丙物质都能够使溴的四氯化碳溶液褪色
D.丙可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
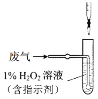
①H2O2氧化SO2的化学方程式______。
② 废气中残留SO2的体积分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及离子方程式书写的评价合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正确 |
B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO32- | 正确 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔、沸点最低
D.W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的多种化合物在生产生活中都有广泛用途。请回答下列问题:
(1)Cu2O和CuO是铜的两种氧化物,可互相转化。已知:
i.2Cu2O(s)+O2(g)=4CuO(s) △H=-292.0kJ·mol-1
ii.C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+35.5kJ·mol-1
若CO的燃烧热为283.0kJ·mol-1,则C(s)的燃烧热为___。
(2)Cu2O和CuO常用作催化剂。
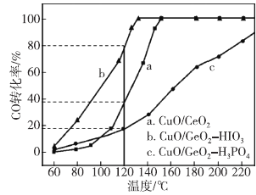
①质子交换膜燃料电池(PEMFC)的燃料气中除含有H2外还含有少量的CO和CO2,其中CO是PEMFC催化剂的严重毒化剂,可用CuO/CeO2作催化剂优先氧化脱除CO。160℃、用CuO/CeO2作催化剂时,氧化CO的化学方程式为___;分别用HIO3和H3PO4对CuO/CeO2进行处理,在一定条件下,利用不同催化剂进行CO氧化的对比实验,得如图曲线,其中催化剂___ (填“b”或“c”)催化性能最好;120℃使用催化剂b进行氧化,若燃料气中CO的体积分数为0.71%,气体流速为2000mL·h-1,则1h后,CO体积为___mL。
②在Cu2O催化作用下合成CH3OH,反应如下:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.0kJ·mol-1,有利于提高该反应CO的平衡转化率的条件是___(填标号)。
CH3OH(g) △H=-90.0kJ·mol-1,有利于提高该反应CO的平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
T℃时,将CO和H2按一定比例混合后投入容积为2L的恒容密闭容器中,CO的起始浓度为1.0mol·L-1,平衡时,测得体系中,n(H2)=1.4mol,n(CH3OH)=1.7mol,反应达到平衡时CO的转化率为___,若反应达到平衡状态后,保持其他条件不变,再充入0.2molCO和0.2molCH3OH,平衡向___(填“正”或“逆”)反应方向移动,理由是___。
(3)CuS呈黑色,是最难溶的物质之一,由于它的难溶性使得一些看似不可能的反应可以发生。向0.01mol·L-1CuSO4溶液中,持续通入H2S维持饱和(H2S饱和浓度为0.1mol·L-1),发生反应:H2S(aq)+Cu2+(aq)![]() CuS(s)+2H+(aq),该反应的化学平衡常数K为___(保留2位有效数字)。已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13,Ksp(CuS)=6.3×10-36。
CuS(s)+2H+(aq),该反应的化学平衡常数K为___(保留2位有效数字)。已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13,Ksp(CuS)=6.3×10-36。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列说法正确的是( )
A.温度不变,压强增大,Y的质量分数减少
B.体积不变,温度升高,平衡向逆反应方向移动
C.m>n
D.Q<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com