
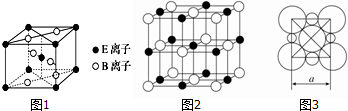
���� A��B��C��D��E�������ֳ���Ԫ�أ����ǵĺ˵����������������Ԫ��E�Ļ�̬3d�������2�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d24s2����EΪTi��A�Ļ�̬ԭ��L���������K���������2����L�������Ϊ4����AΪ̼Ԫ�أ�B�ǵؿ��к�������Ԫ�أ���BΪOԪ�أ�C�Ƕ�����������õĽ���Ԫ�أ���CΪNa��D��C���γ�CD�����ӻ������DΪCl���ݴ˽��
��� �⣺A��B��C��D��E�������ֳ���Ԫ�أ����ǵĺ˵����������������Ԫ��E�Ļ�̬3d�������2�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d24s2����EΪTi��A�Ļ�̬ԭ��L���������K���������2����L�������Ϊ4����AΪ̼Ԫ�أ�B�ǵؿ��к�������Ԫ�أ���BΪOԪ�أ�C�Ƕ�����������õĽ���Ԫ�أ���CΪNa��D��C���γ�CD�����ӻ������DΪCl��
��1��EΪTi��ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d24s2����̬ԭ�Ӽ۲�����Ų�ʽΪ3d24s2���ʴ�Ϊ��3d24s2��
��2��CO2���ӽṹʽΪO=C=O��̼ԭ�ӳ�2���ļ���û�й¶Ե��ӣ���Cԭ�Ӳ�ȡsp�ӻ����ʴ�Ϊ��sp��
��3��CO2�γɵľ������ڷ��Ӿ��壬NaCl�������Ӿ��壬ͨ������£����Ӿ����۵���ڷ��Ӿ����۵㣬��CO2�γɵľ�����۵����NaCl��
�ʴ�Ϊ�����ڣ�CO2�γɵľ������ڷ��Ӿ��壬NaCl�������Ӿ��壻
��4���þ�����Tiԭ�Ӹ���=1+8��$\frac{1}{8}$=2��Oԭ�Ӹ���=2+4��$\frac{1}{2}$=4����Ti��Oԭ�Ӹ���֮��=2��4=1��2����ѧʽΪTiO2���ʴ�Ϊ��TiO2��
��5���ɾ����ṹ��֪��Na+Ϊ����Cl-Ϊ��������Na+������Ŀ=1+12��$\frac{1}{4}$=4��Cl-������Ŀ=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4���ʾ�������=$\frac{4��58.5}{6.02��1{0}^{23}}$g���������=��5.6��10-8cm��3����þ�����ܶ�Ϊ$\frac{4��58.5}{6.02��1{0}^{23}}$g�£�5.6��10-8cm��3=2.2 g•cm-3��
�ʴ�Ϊ��2.2��
���� ������Ҫ������ԭ�Ӻ�������Ų�������ṹ����㡢ԭ�ӹ���ӻ����͵�֪ʶ�����ڿ��鿼���Ի���֪ʶ�����պ�Ӧ��������ע�����þ�̯�����о������㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ2Mg+CO2�T2MgO+C��H��0���ر�Ƕȿ������Է����� | |
| B�� | ���ܱ������������淴Ӧ��2NO��g��+2CO��g��?N2��g��+2CO2��g����H=-113.0kJ/mol���ﵽƽ������¶Ȳ��䣬��С������������´ﵽƽ���H��С | |
| C�� | ��֪��Ksp��AgCl��=1.8��10-10��Ksp��Ag2CrO4��=2.0��10-12�����������Ũ��Ϊ1.0��10-4mol/L��AgNO3��Һ���뵽Ũ��Ϊ1.0��10-4mol/L��KCl��K2CrO4�Ļ����Һ�в������ֲ�ͬ��������Ag2CrO4�����Ȳ��� | |
| D�� | ����HClO��Ka=3.0��10-8mol/L��H2CO3��Ka1=4.3��10-7mol/L��Ka2=5.6��10-11mol/L�����Ʋ���ͬ״���£���Ũ�ȵ�NaClO��Na2CO3��Һ�У�pHǰ��С�ں��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� | ���� | ���ӷ���ʽ | |
| A | �����KI��Һ�еμ�����������Һ | �ڿ����з���һ��ʱ�����Һ����ɫ | 4H++4I-+O2�T2I2+2H2O |
| B | ����ˮ�μӵ���KSCN��Һ���̷���Һ�� | ��Һ��dz��ɫ��Ϊ��ɫ | 2Fe2++Cl2�T2Fe3++2Cl-�� Fe3++3SCN-�TFe��SCN��3 |
| C | �����ƺ��������ƵĻ��Һ�еμ�ϡ���� | ��������ɫ���� | 2S2-+SO32-+6H+�T3S��+3H2O |
| D | ��̪������������Һ�еμ�ϡ���� | �а�ɫ�������ɣ���Һ�ɺ�ɫ��Ϊ��ɫ | Ba2++OH-+H++SO42-�TBaSO4��+H2O |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ��Ӧ | B�� | ������ | C�� | Һ��ӷ� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҵ�ƴֹ� | B�� | ʪ����ͭ | ||
| C�� | ��ϡ������ʯ��ʯ��Ӧ��ȡCO2 | D�� | ϡ������п����Ӧ��ȡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ���Һ | B�� | Ũ��ˮ | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com