
| A. | “海市蜃楼”是一种与光学和胶体性质相关的自然现象 | |
| B. | 铁制管道涂铝粉可防锈蚀 | |
| C. | 锂可用于制造质量轻、容电量大的可充电电池 | |
| D. | 焊锡中铅的作用是提高熔点 |
分析 A、空气中的云属于胶体,具有丁达尔效应;
B、的金属活泼型大于铁;
C、锂质量轻,是一种活泼金属,常用作可充电电池;
D、焊锡中铅的作用是降低熔点.
解答 解:A、海市蜃楼是一种光学现象,在海面上由于太阳光的加热使得海面上的空气从下到上形成密度差,而太阳光在不同密度的介质中的折射率是不同的.使得光线在传播中发生了全反射,从而形成了海市蜃楼,而云属于胶体,通过丁达尔效应可观察到此现象,故A正确;
B、铝的金属活泼型大于铁,铁制管道涂铝粉可防锈蚀;故B正确;
C、锂质量轻,是一种活泼金属,常用作可充电电池,故C正确;
D、铅做催化剂,焊锡中铅的作用是降低熔点,故D错误;
故选D.
点评 本题考查了胶体的性质、加碘食盐,锂电池、太阳能电池板的组成和性质应用.


科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为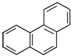 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体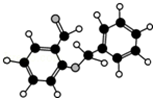 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
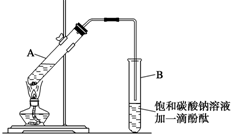 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
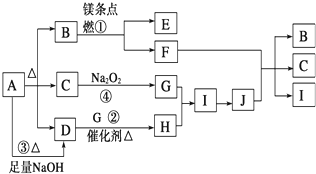
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O存在于乙酸、乙酸乙酯和水中 | B. | 18O只存在于乙醇中 | ||
| C. | 18O只存在于乙酸和水中 | D. | 18O存在于水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com