
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写铜的基态原子价电子电子排布式,
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)配离子[Cu(En)2]2+中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型.
解答 解:(1)Cu是29号元素,原子核外电子数为29,Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故铜的基态原子价电子电子排布式3d104s1,
同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,
故答案为:3d104s1;N>O>C;
(2)配离子[Cu(En)2]2+中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD.
故答案为:ABD.
点评 本题考查元素价电子电子排布式、电离能大小比较、配离子化学键类型,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力,注意同一周期元素电离能变化规律,注意规律中的反常现象及其原因,为高考高频点,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
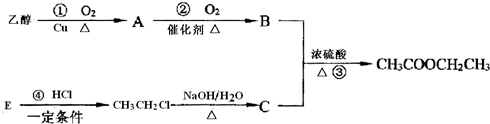
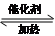 CH3COOCH2CH3+H2O;④CH2=CH2+HCl
CH3COOCH2CH3+H2O;④CH2=CH2+HCl CH3CH2Cl.
CH3CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI,AgBr,AgCl | B. | AgCl,AgI,AgBr | C. | AgBr,AgI,AgCl | D. | AgCl,AgBr,AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
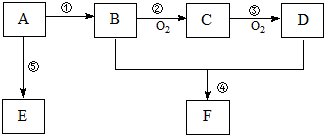
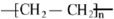 ,B中官能团的名称为羟基.
,B中官能团的名称为羟基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测得0.1mol/L的氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-=2H2O+O2↑+Cl2↑ | |
| C. | 用CuCl2溶液做导电性试验,灯泡发光:CuCl2=Cu2++2Cl- | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑:Cu(OH)2 (s)+S2-?CuS (s)+2 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 | |
| B. | 将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16 kJ | |
| D. | 当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
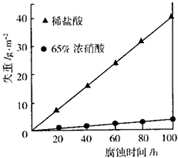 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com