
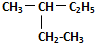 和
和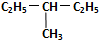 .
. 分析 (1)同分异构体是具有相同的分子式和不同结构的有机物之间的互称;
(2)质子数相同,中子数不同的原子互称同位素;
(3)结构、分子式一样的属于同种物质;
(4)结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物.
解答 解:A.11H和12H,质子数相同,中子数不同,属于同位素;
B.甲烷和乙烷,结构相似,分子组成上相差1个CH2基团,属于同系物;
C.金刚石、石墨和C60,均是碳元素形成的不同种单质,互为同素异形体;
D.丁烷和异丁烷,分子式相同,结构不同,属于同分异构体;
E. 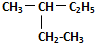 和
和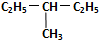 ,分子式相同,结构相同,属于同种物质,
,分子式相同,结构相同,属于同种物质,
故答案为:(1)D;(2)A;(3)E;(4)B.
点评 本题考查了同分异构体、同位素、同素异形体、同系物的判断,题目难度不大,明确概念是解本题的关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
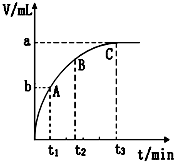 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
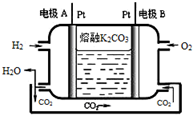 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: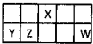
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
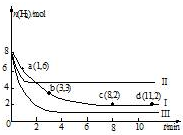 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 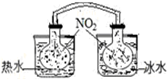 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 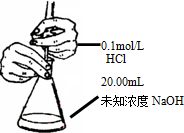 测定锥形瓶内的NaOH的浓度 | |
| C. | 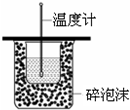 测定中和热 | |
| D. | 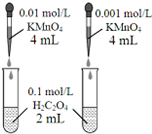 依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com