
为探究NaHCO3、Na2CO3与1mol·L-1盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据。下列有关说法正确的是( )
序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
① | 35 mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
② | 35 mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
③ | 35 mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
④ | 35 mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:选择题
“地沟油”在一定条件下,能发生如下反应,化学方程式为:
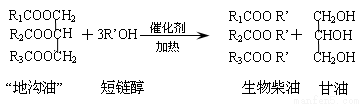
下列叙述错误的是
A.“地沟油”主要成分是高级脂肪酸的甘油酯
B.生物柴油是不同酯组成的混合物
C.生物柴油属于化石燃料
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
下列分子式只能表示一种物质的是( )
A.C2H6O B.C3H7Cl C.CH2Cl2 D.C2H4O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一下期末化学试卷(解析版) 题型:选择题
下列各组变化中,化学反应的反应热前者小于后者的一组是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2;
②2H2(g)+O2(g)===2H2O(l) ΔH1;
H2(g)+O2(g)===H2O(l) ΔH2;
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2;
④CaCO3(s)===CaO(s)+CO2(g) ΔH1;
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2;
A.①② B.②③
C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:填空题
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇(CH3OH)蒸汽和水蒸气CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下图表示恒压容器中充入1mol CO2和3 mol H2,转化率达50%时的能量变化示意图。写出该反应的热化学方程式: 。
CH3OH(g)+H2O(g)。下图表示恒压容器中充入1mol CO2和3 mol H2,转化率达50%时的能量变化示意图。写出该反应的热化学方程式: 。

(2)另外工业上还可用CO和H2制备甲醇。 反应为CO(g)+2H2(g) CH3OH(g),
CH3OH(g),
某温度下,在容积为2L的恒容密闭容器中进行该反应,其相关数据见下图:

① t min至2t min时速率变化的原因可能是 ;
② 3t min时对反应体系采取了一个措施,至4t min时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)CO2在一定条件下,还可以与H2合成二甲醚:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
将2.5 mol H2与b mol CO2置于容积为1 L的密闭容器中,发生上述反应,达到平衡状态时,测得实验数据如下表:

① 降温时,上述平衡向_________方向移动(填“正反应”或“逆反应”)。
②表中x、y的大小关系为_________。
A.x=y B.x>y C.x<y D.无法判断
③表中x、y、z、w对应的平衡常数分别为Kx、Ky、Kz、Kw,它们之间的大小关系为___________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
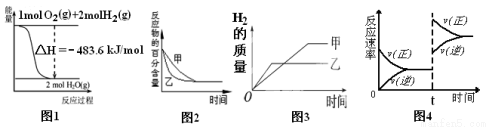
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ/mol
B.图2表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示达到化学平衡后,在t时刻增加了反应物的浓度后,正逆反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
将1L 0.1 mol•L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L
0.5 mol•L-1HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;将500 mL
1 mol•L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出的热量为( )
A.(5a-2b)kJ B.(2b-5a)kJ
C.(5a+2b)kJ D.(10a+4b)kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下学期期末化学试卷(解析版) 题型:实验题
乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
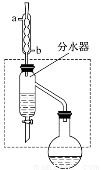
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是___________________________________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________________(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是 。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将乙酸丁酯从分液漏斗的上口倒出
B.直接将乙酸丁酯从分液漏斗的下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com