
| A. | pH试纸使用之前需用蒸馏水润湿 | |
| B. | 用广泛pH试纸测定某溶液的pH为3.5 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 中性溶液的c(H+)=$\sqrt{K_W}$mol•L-1 |
分析 c(H+)与c(OH-)的相对大小可判定溶液的酸碱性,且Kw与温度有关,测定pH时试纸不能润湿,以此来解答.
解答 解:A.pH试纸使用之前不能用蒸馏水润湿,否则可能有误差,故A错误;
B.用广泛pH试纸测定某溶液的pH为3或4,为正整数,故B错误;
C.pH=7的溶液不一定呈中性,如100℃pH=6为中性,故C错误;
D.c(H+)=$\sqrt{K_W}$mol•L-1,即c(H+)=c(OH-),溶液为中性,故D正确;
故选D.
点评 本题考查溶液的酸碱性,为高频考点,把握酸碱性的判断方法、pH与酸碱性的关系为解答的关键,侧重分析与应用能力的考查,注意pH的测定方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
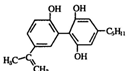
| A. | 该有机物不仅能使溴水、酸性 KMnO4 溶液褪色,也能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下该有机物能发生加成反应、氧化反应、取代反应,也能发生聚合反应 | |
| C. | 该有机物中可能存在手性碳原子 | |
| D. | 该有机物显弱酸性,能与 NaOH 溶液、NaHCO3 溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com