
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 镁与稀硫酸反应 | D. | 氧化钙溶于水 |
分析 反应中生成物总能量高于反应物总能量的是吸热反应,而常见的吸热反应有:绝大多数的分解反应;铵盐和碱的反应;以C、氢气或CO为还原剂的氧化还原反应等,以此解答该题.
解答 解:生成物总能量高于反应物总能量,为吸热反应,
A.碳酸钙受热分解,属于吸热反应,故A正确;
B.乙醇燃烧放出大量的热,属于放热反应,故B错误;
C.镁与稀硫酸反应,为活泼金属与酸的反应,属于放热反应,故C错误;
D.氧化钙与水反应生成氢氧化钙,属于放热反应,故D错误.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力和双基的掌握,有利于培养学生良好的科学素养,难度不大,注意常见吸热反应与放热反应的类型.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不能与HNO3、H2SO4等所有的酸反应 | |
| B. | 由Na2CO3+SiO$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑可知硅酸的酸性比碳酸的酸性强 | |
| C. | 硅胶常用于做干燥剂 | |
| D. | CO2与SiO2均是酸性氧化物,溶于水均得到相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
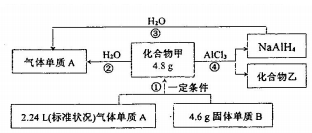
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓氨水中加固体NaOH | B. | 混合NH4Cl溶液和NaOH溶液 | ||
| C. | 加热分解NH4Cl晶体 | D. | 加热消石灰和NH4NO3的固体混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com