
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
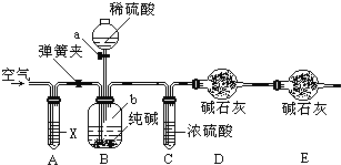
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
【答案】将装置内残留的二氧化碳全部排出,达到精确测量的目的 NaOH 偏大 CO32﹣+2H+═H2O+CO2↑ 88.3%
【解析】
(1)据实验目的来分析装置A中碱液的作用;
(2)据装置C的作用可以知道对测定结果的影响;
(3)据酸与盐的反应规律,反应物、生成物可写出反应的离子方程式;
(4)分析实验前后装置D质量变化,并由此质量差来计算样品中碳酸钠的质量,求出样品中碳酸钠的质量分数。
(1)根据题意可以知道我们是通过测定二氧化碳的质量来测定碳酸钠的质量分数的,所以要排除空气中的二氧化碳干扰实验结果,而在A中装了碱性溶液来吸收空气中的二氧化碳,故装置A中试剂可选用NaOH;
因此,本题正确答案是:将装置内残留的二氧化碳全部排出,达到精确测量的目的;NaOH;
(2)浓硫酸具有吸水性,在C装置中吸收由B装置排出气体中混有的水蒸气,若少了此装置则会使气体中的水蒸气被D装置中碱石灰吸收,而使测定质量偏大,故填偏大;
因此,本题正确答案是:偏大;
(3)据酸与盐的反应规律,稀硫酸和碳酸钠反应的离子方程式为:CO32﹣+2H+═H2O+CO2↑,
因此,本题正确答案是:CO32﹣+2H+═H2O+CO2↑;
(4) 反应中放出二氧化碳的质量为:87.6g-85.4g=2.2g,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106g 44g
m 2.2g
m=![]() =5.3g,
=5.3g,
纯碱样品中碳酸钠的质量分数为:![]() ×100%=88.3%,
×100%=88.3%,
因此,本题正确答案是:88.3%.


科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子。
(1)写出A的离子结构示意图:___________,B在周期表的位置:______________,写出C的元素符号________,D的最高价氧化物化学式_______。
(2)比较D的气态氢化物与H2S和HF的稳定性:______>_______>______
(3)C与D两元素最高价氧化物的水化物发生化学反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 氯化钠水溶液在电流的作用下电离出Na+和Cl
B. 硫酸钡难溶于水,但硫酸钡属于电解质
C. 二氧化碳溶于水能导电,故二氧化碳属于电解质
D. 硫酸钠在水中的电离方程式可表示为Na2SO4![]() 2Na++S6++4O2
2Na++S6++4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.5mol/L亚硫酸溶液中含有的H+数日小于NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为1.5NA
C. 1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA
D. lmolSO2和0.5mo102在VL的密闭容器中充分反应,生成SO3的分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三位分别来自瑞士、美国、英国的科学家因发展“冷冻电子显微镜技术对溶液中的生物分子进行高分辨率结构测定”所做出的贡献而获得2017年诺贝尔化学奖。含有有机杂化锌、锗以及砷等金属的硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为_________。位于元素周期表五个分区中的________区。
(2)元素锗与砷中,第一电离能较大的是________ (填元素符号,下同),基态原子核外未成对电子数较少的是________。
(3)元素砷与氮同主族,二者的氢化物中熔沸点较高的是_________,原因是________。
(4)H2SeO3分子中Se 原子的杂化形式为________,H2SeO4的酸性比H2SeO3强,原因是________ 。
(5)气态SeO3分子的立体构型为______,与SeO3互为等电子体的一种离子为_____(填离子符号)。
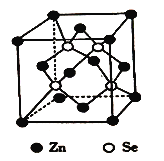
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_____,若该晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏伽德罗常数的数值,则晶胞参数α为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
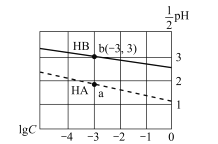
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是
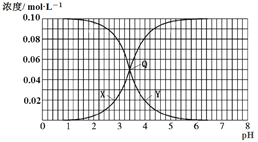
A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。
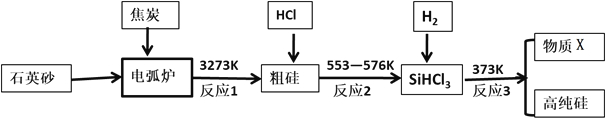
(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com