
| 2NA×11.2L |
| 44.8L |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O |
| B、稀H2SO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、Fe(OH)3沉淀中加入足量HI:Fe(OH)3+3H+=Fe3++3H2O |
| D、AlCl3溶液中与过量氨水混合:Al3++3NH3?H2O=3NH4++Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
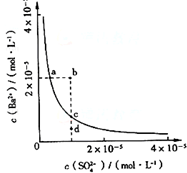
| A、加入Na2SO4可以使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、a、b、c、d点溶液中Kw相等 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、10秒内氨气的平均反应速率为0.025mol?L-1?s-1 |
| C、达平衡后,分离出少量NH3,v正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 初始浓度(mol/L) | 平衡浓度(mol/L) | ||||
| c0(N2) | c0(H2) | c0(NH3) | c平(N2) | c平(H2) | c平(NH3) |
| 2.48 | 4.34 | 0 | 1.85 | 2.43 | 1.27 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.8 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

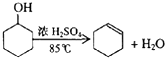
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
| 环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
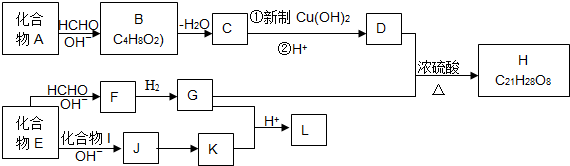
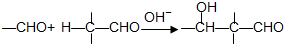
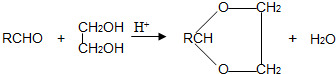
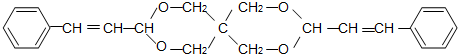
查看答案和解析>>
科目:高中化学 来源: 题型:
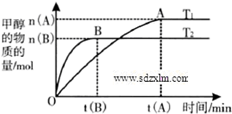 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com