
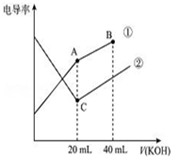
 �絼���Ǻ����������Һ����������С��������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㣮��ͼ��ijͬѧ��0.1mol/L KOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/L��HCl��CH3COOH��Һ�ζ�����ʾ��ͼ�������Һ����仯���Բ��ƣ��������й��жϲ���ȷ���ǣ�������
�絼���Ǻ����������Һ����������С��������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㣮��ͼ��ijͬѧ��0.1mol/L KOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/L��HCl��CH3COOH��Һ�ζ�����ʾ��ͼ�������Һ����仯���Բ��ƣ��������й��жϲ���ȷ���ǣ�������| A�� | ���ߢٴ���0.1 mol/L KOH��Һ�ζ�CH3COOH��Һ�ĵζ����ߣ����ߢڴ���0.1 mol/L KOH��Һ�ζ�HCl��Һ�ĵζ����� | |
| B�� | ����ͬ�¶��£�C��ˮ�����c��H+��С��A��ˮ����� c��H+�� | |
| C�� | ��A�����Һ���У�c��CH3COO-��+c��OH-��-c��H+��=0.1 mol/L | |
| D�� | ��B�����Һ���У�c��K+����c��OH-����c��CH3COO-����c��H+�� |
���� A����Һ��������������Ũ�ȳ����ȣ�CH3COOH��������ʣ���Һ������Ũ�Ƚ�С������KOH����Һ������Ũ��������Һ��������ǿ��HCl��ǿ����ʣ�����KOH��Һ���룬��Һ�����������Һ������Ũ�ȼ�С����Һ������������������ȫ��Ӧʽ����Ũ����С����������KOH��Һ������Ũ��������Һ����������ǿ��
B����������ˮ���룬���������ӵ��δٽ�ˮ���룻
C���κε������Һ�ж����ڵ���غ㣬���ݵ���غ��жϣ�
D��B��ʱ�������Һ��Ϊ�����ʵ���Ũ�ȵ�KOH��CH3COOK����Һ�ʼ��ԣ�CH3COO-ˮ��̶Ƚ�С����������غ��жϣ�
��� A����Һ��������������Ũ�ȳ����ȣ�CH3COOH��������ʣ���Һ������Ũ�Ƚ�С������KOH����Һ������Ũ��������Һ��������ǿ��HCl��ǿ����ʣ�����KOH��Һ���룬��Һ�����������Һ������Ũ�ȼ�С����Һ������������������ȫ��Ӧʽ����Ũ����С����������KOH��Һ������Ũ��������Һ����������ǿ������ͼ֪�����ߢڴ���0.1 mol/L KOH��Һ�ζ�HC1��Һ�ĵζ����ߣ����ߢٴ���0.1 mol/LKOH��Һ�ζ�CH3COOH��Һ�ĵζ����ߣ���A��ȷ��
B����������ˮ���룬���������ӵ��δٽ�ˮ���룬C������ΪNaCl��A������Ϊ�����ƣ��ٽ�ˮ���룬��������ͬ�¶��£�C��ˮ�����c��H+��С��A��ˮ�����c��H+������B��ȷ��
C���κε������Һ�ж����ڵ���غ㣬���ݵ���غ��c��CH3COO-��+c��OH-��-c��H+��=c��Na+��=0.05mol/L����C����
D��B��ʱ�������Һ��Ϊ�����ʵ���Ũ�ȵ�KOH��CH3COOK����Һ�ʼ��ԣ�CH3COO-ˮ��̶Ƚ�С����������غ������Ũ�ȴ�С˳����c��K+����c��OH-����c��CH3COO-����c��H+������D��ȷ��
��ѡC��
���� �����Ե絼��Ϊ���忼������Ũ�ȴ�С�Ƚϡ�����ˮ���֪ʶ�㣬��Ŀ�Ѷ��еȣ���ȷ�����Һ�����ʼ������ʡ���Һ������ǿ��Ӱ�������ǽⱾ��ؼ����״�ѡ����C��ע��A����Һ�����ԭ��2��������Ũ�Ƚ�Ϊԭ��һ�룬����������ѧ���ķ������������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����£���a�㣨pH=a����20.00mL 1.000mol•L-1��ˮ�е���1.000mol•L-1���ᣬ��ҺpH���¶��������������仯������ͼ��ʾ�������й�˵��������ǣ�������
�����£���a�㣨pH=a����20.00mL 1.000mol•L-1��ˮ�е���1.000mol•L-1���ᣬ��ҺpH���¶��������������仯������ͼ��ʾ�������й�˵��������ǣ�������| A�� | ���˰�ˮϡ�ͣ���Һ�ĵ����������� | |
| B�� | b����Һ������Ũ�ȴ�С���ܴ��ڣ�c��NH${\;}_{4}^{+}$����c��Cl-����c��OH-����c��H+�� | |
| C�� | c��ʱ�����������V��HCl����20.00mL | |
| D�� | a��d�������Һ��ˮ�����ӻ�Kw��a����Kw��d�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �׳ƾƾ� | B�� | ����������Ʒ�Ӧ | ||
| C�� | �Ҵ����������� | D�� | �������ᷢ��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| X | ||
| Y | ||
| Z |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������NaCl���� | B�� | �μ���������ͭ��Һ | ||
| C�� | ��������ˮ | D�� | ��������CH3COONa���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȩ��Һ������������ͭ����Һ����CH3CHO+2Cu��OH��2+OH-$\stackrel{��}{��}$CH3COO-+Cu2O��+2H2O | |
| B�� | ������Һ������������ͭ��Ӧ��2H++Cu��OH��2��Cu2++2H2O | |
| C�� | ��������Һ��ͨ������������̼��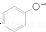 +CO2+H2O$\stackrel{��}{��}$ +CO2+H2O$\stackrel{��}{��}$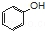 +HCO3- +HCO3- | |
| D�� | ��������������������Һ��Ӧ��CH3COOCH2CH3+OH-��CH3COO-+CH3CH2O-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��1����֪H-H ����Ϊ436kJ•mol-1��H-N������Ϊ391kJ•mol-1�����ݻ�ѧ����ʽ��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1����N��N���ļ�����945.6kJ•mol-1
��1����֪H-H ����Ϊ436kJ•mol-1��H-N������Ϊ391kJ•mol-1�����ݻ�ѧ����ʽ��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1����N��N���ļ�����945.6kJ•mol-1�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com