
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
分析 A.高锰酸钾能氧化盐酸;
B.三价铁离子为弱碱阳离子,部分水解生成氢氧化铁;
C.H2O2做氧化剂产物为水;
D.蒸发操作不能直接蒸干.
解答 解:A.高锰酸钾能氧化盐酸,则一般用稀硫酸酸化高锰酸钾溶液,故A错误;
B.三价铁离子为弱碱阳离子,部分水解生成氢氧化铁,所以制取的氯化铁中含有杂质氢氧化铁,依据盐类水解平衡移动原理,加入盐酸可以抑制氯化铁的水解,故B正确;
C.H2O2做氧化剂产物为水,无污染,故C正确;
D.蒸发操作不能直接蒸干,以防止温度过高而导致分解而变质,故D正确.
故选A.
点评 本题考查化学实验方案的评价,涉及氧化还原反应、盐类的水解以及实验操作等,为高频考点,侧重反应原理及实验操作的考查,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图1为分子立体结构示意图.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N${\;}_{3}^{-}$.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加少量氨水:Al3++3OH-═Al(OH)3↓+2H2O | |
| B. | 向氯化铁溶液中加入过量的锌粉:Zn+2Fe3+═2Fe2++Zn2+ | |
| C. | 以铁为电极电解NaCl溶液时,阳极的电极反应:Fe-3e-═Fe3+ | |
| D. | 硝酸亚铁溶液中滴入浓盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
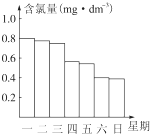 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )
某温度下,溶液中c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x和y的关系如图所示.则该温度下,0.01mol•L-1的NaOH溶液的pH为( )| A. | 10 | B. | 11 | C. | 13 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2含有氧原子数为NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 23gNa在足量的O2中充分燃烧失去2mole-生成Na2O2 | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com