
| A. | H2(HCl):通过水洗涤 | B. | NO(NH3):通过水洗涤 | ||
| C. | NH4Cl(I2):加热混合物 | D. | NH4Cl溶液(I2):用CCl4萃取 |
科目:高中化学 来源: 题型:解答题
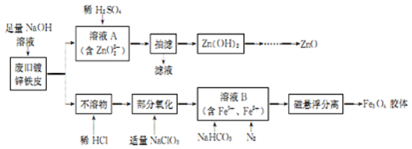
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
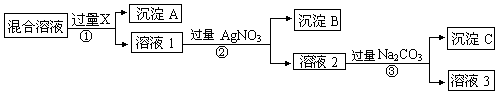
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

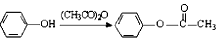
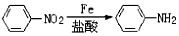
 .
.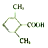 (或
(或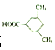 ).
).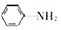 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物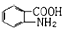 的合成路线
的合成路线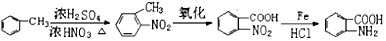 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
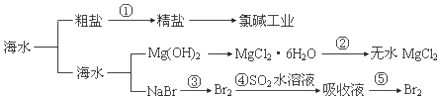
| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 工业生产中常选用石灰乳作为 Mg2+的沉淀剂 | |
| C. | 第②步的反应条件是:在空气中直接加热 | |
| D. | 第③步到第⑤步的目的是为了富集溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
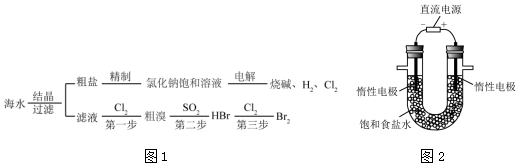
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com