
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键.
解答 解:SO2分子中C与O原子之间只存在共价键,属于共价化合物;
CaO中钙离子和氧离子之间只存在离子键,属于离子化合物;
D2中氢原子之间只存在非极性键,是单质;
HCl分子中H-Cl原子之间只存在共价键,属于共价化合物;
Na2CO3中钠离子和碳酸根离子之间存在离子键、O与C原子之间存在共价键,属于离子化合物;
通过以上分析知,属于共价化合物的是SO2、HCl,
含非极性键的是D2;
故答案为:SO2、HCl;D2.
点评 本题考查化学键和化合物的关系,题目难度不大,侧重考查基本概念,明确物质构成微粒及存在的化学键即可解答,注意离子键和共价键的区别.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
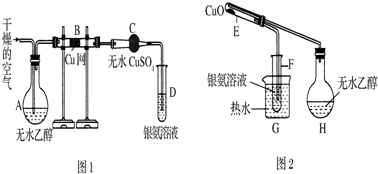
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长不相等,键角不相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
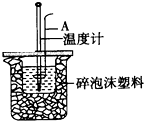 某实验小组用0.50mol/L NaOH 溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH 溶液和0.50mol/L硫酸溶液进行中和热的测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氢氧化钠、干冰 | B. | 澄清石灰水、铜、氨气 | ||
| C. | 石油、水、硫酸钡 | D. | 海水、氯化钠、氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 便于形成规则的几何外形 | |
| B. | 微观微粒结合得越紧密,体系总能量越低,体系越稳定 | |
| C. | 便于使晶体具有对称性 | |
| D. | 为了使晶体具备各向异性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com