
分析 根据盖斯定律(2)+(4)-(1)+(3)得:NH4Cl(s)+2H2O(l)=NH4Cl(aq),据此计算出该反应的焓变,根据计算结果偏大反应吸热还是放热.
解答 解:(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176kJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1kJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3kJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3kJ/moL
根据盖斯定律:(2)+(4)-(1)+(3)得:
NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=(-35.1kJ•mol-1)+(-52.3kJ•mol-1)-(-176kJ•mol-1)+(-72.3kJ•mol-1)
即NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=△H=+16.3kJ•mol-1
所以NH4Cl(s)+2H2O(l)=NH4Cl(aq)的反应热是+16.3kJ•mol-1,该反应为吸热反应,
故答案为:吸热; 16.3kJ/mol.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确盖斯定律的内容为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为吸收能量反应 | |
| C. | 同一反应在不同温度下进行,其焓变是不同的 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
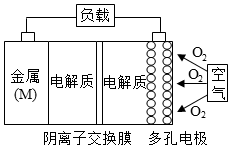 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )| A. | 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH- | |
| B. | 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 | |
| D. | 与铝一空气电池相比,镁一空气电池的比能量更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
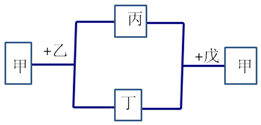 短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲为元素Z的单质,通常为淡黄色固体,乙、丙、丁、戊为这些元素组成的化合物,常温下0.1mol•L-1乙溶液pH为13,戊为Z的最高价氧化物的水化物.上述物质间的转化关系如图所示(部分产物及反应条件已略去).下列说法正确的是( )| A. | 简单离子的半径大小X<Y<Z | |
| B. | 化合物乙中含离子键和非极性共价键 | |
| C. | W与Z形成的化合物常温常压下呈液态 | |
| D. | 图中生成甲的离子方程式为6H++SO32-+2S2-=3S↓+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com