



科目:高中化学 来源:不详 题型:单选题

| A.X元素位于第ⅥA族 |
| B.A不能溶解于B中 |
| C.A和C不可能发生氧化还原反应 |
| D.B的沸点高于C的沸点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:HF<HCl<HBr | B.微粒半径: O2->Mg2+>Cl- |
| C.第一电离能:Si>Al>Mg | D.电负性:Si>Al>Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgF2 | B.MgCl2 | C.CaCl2 | D.CaBr2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
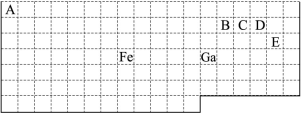
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、Y、Z一定处于同一周期 |
| B.X可能是镁 |
| C.Y和Z的最高价氧化物对应的水化物在一定条件下能反应 |
| D.工业上冶炼X、Y、Z通常是用热还原法制得 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com