
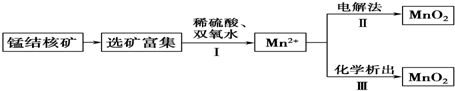
| A. | 反应Ⅰ的离子方程式为MnO2+H2O2+2H+═Mn2++2H2O+O2↑ | |
| B. | 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O═MnO2↓+4H+ | |
| C. | 若加入KClO3,则反应Ⅲ为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+ | |
| D. | 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+ |
分析 A.双氧水具有还原性,二氧化锰具有氧化性,二者在酸性环境下发生氧化还原反应;
B.在电解池的阴极上发生得电子的还原反应;
C.根据流程图的转化,结合氧化还原理论即可写出离子方程式;
D.KMnO4具有强氧化性,结合流程图的转化,根据氧化还原理论即可写出离子方程式.
解答 解:A.双氧水具有还原性,在酸性环境下,得到的氧化产物是氧气,二氧化锰具有氧化性,在酸性环境下,得到还原产物是锰离子,二者在酸性环境下发生氧化还原反应,反应的离子方程式为:MnO2+2H++H2O2═Mn2++O2↑+2H2O,故A正确;
B.在电解池的阴极上发生得电子的还原反应,Mn2+-2e-+2H2O═MnO2↓+4H+为失电子的氧化反应在阳极上发生,故B错误;
C.根据流程图的转化,结合氧化还原理论即可写出离子方程式为2ClO3-+5Mn2++4H2O═5MnO2↓+Cl2↑+8H+,故C正确;
D.KMnO4具有强氧化性,结合流程图的转化,根据氧化还原理论反应Ⅲ为Mn2+与MnO4发生归中反应,即反应Ⅲ为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+,故D正确;
故选B.
点评 本题考查氧化还原反应方程式及电解池电极反应式的书写,解答本题时要充分理解图中提供的信息,理解了图中信息能对问题做出正确的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
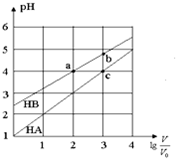 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| C. | 溶液中水的电离程度:a=c>b | |
| D. | 当$lg\frac{V}{V_0}=3$时,若两溶液同时升高温度,则$\frac{{c({B^-})}}{{c({A^-})}}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
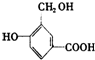 的结构回答下列问题:
的结构回答下列问题: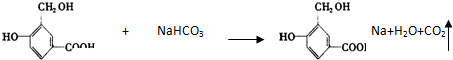
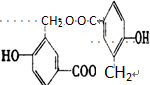 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ③④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | B | d |
| 酒 精(水) | A | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 含有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com