
| A. | 体积 ②>③>④>① | B. | 密度 ②>③>①>④ | ||
| C. | 质量 ②>③>①>④ | D. | 氢原子个数 ②>④>③>① |
分析 结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$、ρ=$\frac{M}{Vm}$及分子构成计算.
解答 解:①6.72L CH4的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,质量为0.3mol×16g/mol=4.8g,含H原子为1.2mol;
②3.01×1023个HCl分子中的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,质量为0.5mol×36.5g=18.25g,体积为0.5mol×22.4L/mol=11.2L,含H原子为0.5mol;
③13.6g H2S的物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,体积为0.4mol×22.4L/mol=8.96L,含H原子为0.8mol;
④0.2mol NH3的质量为0.2mol×17g/mol=3.4g,体积为0.2mol×22.4L/mol=4.48L,含H原子为0.6mol,则
A.体积为 ②>③>①>④,故A错误;
B.M越大,密度越大,则密度 ②>③>④>①,故B错误;
C.质量 ②>③>①>④,故C正确;
D.H原子物质的量越大,个数越多,则氢原子个数 ①>③>④>②,故D错误;
故选C.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积、微粒数的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同,半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,释放能量,由基态转化成激发态 | |
| D. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-=Cu(OH)2↓CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2OBaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓Ca(NO3)2+Na2CO3═CaCO3↓+NaNO3 | |
| D. | H++OH-=H2OBa(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:C>D>A>B | B. | 核电核数:b>a>d>c | ||
| C. | 原子半径:A>B>D>C | D. | 元素的电负性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
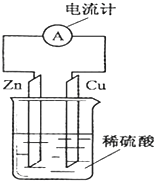
| A. | 电子由铜片通过导线流向锌片 | |
| B. | 铜为正极,铜不易失电子而受到保护 | |
| C. | 锌片为负极,且锌片逐渐溶解 | |
| D. | 该装置能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当10NA个电子转移时,该反应放出1300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当8NA个碳氧共用电子对生成时,吸收1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L氧气中,一定含有2 mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4 L | |
| D. | 标准状况下,20 mL NH3跟60 mL O2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
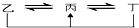 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出): .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com