
【题目】往1.0 mol·L-1KI溶液中加入固体I2,发生反应:I2(aq)+I-(aq)![]() I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
I3-(aq) △H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示。已知反应第一次达到平衡时用时10s,则下列说法正确的是
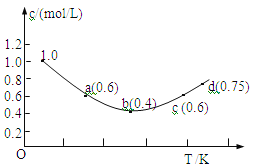
A. 该反应的△H>0
B. a、c两点对应的I-反应速率相等
C. b点时0~10s I-的平均反应速率为0.04mol·L-1·s-1
D. d点时该反应在对应温度下处于平衡状态
科目:高中化学 来源: 题型:
【题目】Ⅰ.同温、同压下,A、B两容器分别充满O2和O3,请回答下列问题:
若两容器所含O2和O3分子总数相等,则A容器和B容器的容积之比是________;
若两容器中所含原子总数相等,则A容器和B容器的容积比是_______;
Ⅱ.等质量的CO和CO2原子数之比为________
Ⅲ.用下列物质序号填空:
①金属铜 ②固态NaCl③石墨棒④NaCl溶液 ⑤CO2 ⑥熔融的KNO3 ⑦ HCl ⑧稀硫酸 ⑨酒精溶液
其中能导电的是_________ ,非电解质是__________ ,强电解质的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
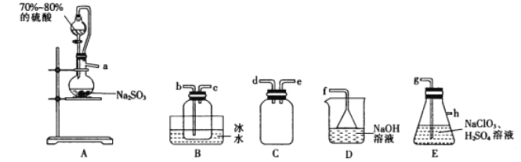
回答下列问题:
(1)仪器X的名称是________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→_________________________(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为__________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是__________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)
①配制100mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和______。
②原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
2NH3(g) △H=-92.4 kJ·mol-1。在恒容密闭容器内,投入2mol N2和6mol H2发生反应,当反应达到平衡状态时,下列说法不正确的是
A. 当其他条件不变的情况下,升高温度,原有的平衡被破坏,逆反应速率增大,正反应速率减小
B. 一定存在2v(H2)正=3 v(N2)逆
C. 反应过程中可能放出92.4 kJ的热量
D. 容器内混合气体的平均相对分子质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对淀粉水解产物的综合利用,可以获得多种有机物。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
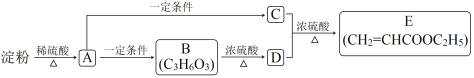
已知B能与Na2CO3反应,B的催化氧化产物不能发生银镜反应,且1mol B与足量金属钠反应产生1mol H2。
请回答:
(1)D中所含官能团名称是___________。(2)B的结构简式是_______________。
(3)C+D→E的化学方程式是____________。
(4)下列说法正确的是_________。
A.将一小粒钠投入C中,钠始终浮在液面上缓慢放出气泡,同时得到能使酚酞试液变红的物质
B.在一定条件下,D和E都能通过加聚反应生成高聚物
C.共mg A和B的混合物在氧气中完全燃烧,消耗22.4m/30 L氧气
D.B在浓硫酸作用下反应可能生成六元环状化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
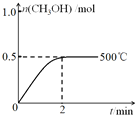
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。
(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
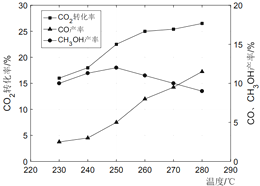
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
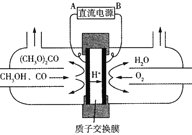
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某容积一定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2)
C. 1 mol H—H键断裂的同时断裂2 mol H—O键
D. 生成n mol CO的同时消耗n mol H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种有机物A、B、C互为同分异构体,均由C、H、O三种元素组成,且分子中C、H、O元素的质量比为15:2:8,其相对分子质量通过质谱法测得为100。又知化合物A能发生银镜反应,属于直链结构,分子中有3种不同化学环境的氢,且原子个数比为1:1:2。B为五元环酯。C的红外光谱表明其分子中存在甲基。其它物质的转化关系如下:
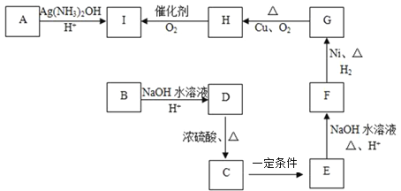
完成下列填空:
(1)A的分子式是______________,A分子中的官能团名称是_________________。
(2)B和G的结构简式分别是_____________、_____________。
(3)D→C反应的化学方程式为_________________________________________。
(4)由单体F发生加聚反应生成的产物的结构简式是___________。
(5)试设计一条以![]() 为主要原料制备
为主要原料制备![]() 的合成路线_____,(合成路线常用的表示方式为:甲
的合成路线_____,(合成路线常用的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com