
| A、ICH2CH2I |
| B、ClCH2CH2Br |
| C、ClCH2CH2I |
| D、ClCH2CH2Cl |
科目:高中化学 来源: 题型:
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
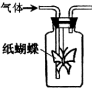 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )| A | B | C | D | |
| 喷洒液 | 酚酞 | 紫色石蕊 | 酸性高锰酸钾 | 酸化的KI-淀粉 |
| 通入的气体 | NH3 | Cl2 | CH2=CH2(g) | NO2 |
| 预测的颜色变化 | 变为红色 | 最终褪色 | 褪色 | 无明显变化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
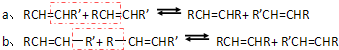
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积比为11:8 |
| B、分子个数之比为1:1 |
| C、物质的量之比为11:8 |
| D、原子个数之比为12:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L溶液中阴阳离子总数为1.2NA |
| B、500 mL溶液中NO3-浓度为0.2 mol/L |
| C、500 mL溶液中Ba2+浓度为0.2 mol/L |
| D、500 mL溶液中NO3-物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
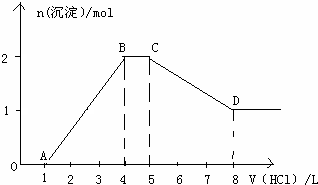
| 阴离子种类 | |||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:
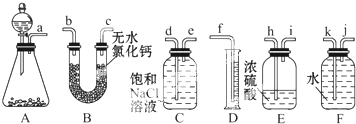
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com