
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
分析 由表格中数据可知,A、B、C的浓度变化量之比为(1.5-0.9):(1-0.8):(0.4-0)=3:1:2,由速率之比等于化学计量数之比可知,a=3,b=1,则
3A(g)+B(g)?2C(g)
开始 1.5 1 0
转化 0.6 0.2 0.4
2s 0.9 0.8 0.4
然后结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%及平衡的特征“等、定”判定平衡状态来解答.
解答 解:(1)①A、B、C的浓度变化量之比为(1.5-0.9):(1-0.8):(0.4-0)=3:1:2,由速率之比等于化学计量数之比可知,a=3,b=1,则反应为3A (g)+B (g)?2C(g),故答案为:3A (g)+B (g)?2C(g);
②0到2s用物质B来表示的反应速率为$\frac{1mol/L-0.8mol/L}{2s}$=0.1 mol/(L•s),
故答案为:0.1 mol/(L•s);
③从反应开始到2s末,A的转化率为$\frac{0.6mol/L}{1.5mol/L}$×100%=40%,
故答案为:40%;
④A.vB(反应)=vC(生成),同种物质的正逆反应速率不等,不是平衡状态,故不选;
B.容器内气体的总压强保持不变,各物质的物质的量不变,为平衡状态,故选;
C.质量、体积均不变,容器内气体的密度始终不变,不能判定平衡状态,故不选;
D.vA:vB:vC=3:2:2始终存在,不能判定平衡状态,故不选;
E.容器内气体C的物质的量分数保持不变,为平衡状态,故选;
故答案为:BE.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据的应用、速率及转化率计算、平衡判定等为解答的关键,侧重分析与应用能力的考查,注意平衡的特征分析平衡状态,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
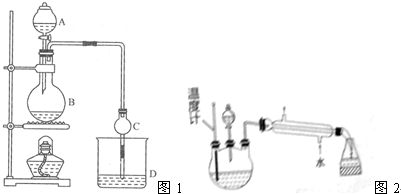
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
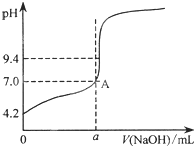 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
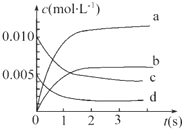 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
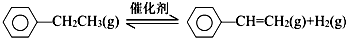
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
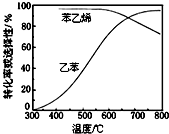
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
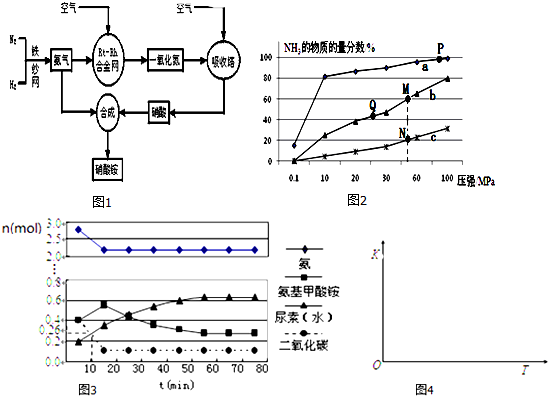
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
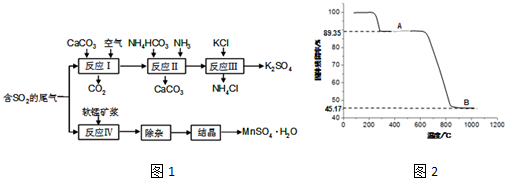
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com