
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的单质一定能将Y从NaY的水溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
分析 根据单质之间的置换反应、气态氢化物的稳定性、最高价含氧酸的酸性、与氢化合的难易、元素周期律等来比较非金属性,以此来解答.
解答 解:A.X原子的电子层数比Y原子的电子层数多,为同主族元素,则Y的非金属性强,不同主族元素不能比较,故A不选;
B.Y的单质能将X从NaX的溶液中置换出来,则Y的非金属性强,故B不选;
C.X的单质比Y的单质更容易与氢气反应,说明X的得电子能力更强,则X的非金属性强,故C选;
D.X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强,不能说明X的非金属性比Y强,如HCl的酸性大于HF,但是非金属性F大于Cl,故D不选;
故选C.
点评 本题考查非金属性的比较,注意归纳非金属性比较的方法是解答的关键,明确同主族元素性质的变化规律即可解答,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
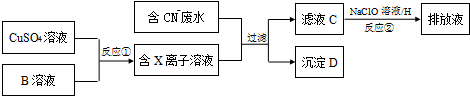
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度 | |
| B. | 将锌粒改为锌粉 | |
| C. | 将所用硫酸改为98%左右的硫酸溶液 | |
| D. | 寻找一种合适的催化剂并加入其中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生产物的总能量有可能相同 | |
| D. | 如果旧化学键断裂吸收的能量大于新化学键形成释放的能量,则该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素 | |
| B. | 原子序数为48的元素 | |
| C. | 原子核外L层比M层多一个电子的元素 | |
| D. | 原子核外M层有8个电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

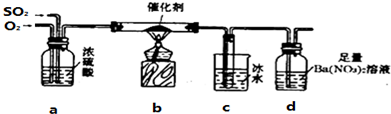

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com