
| 0.5g |
| 2g/mol |
| 2n+2 |
| 4 |
| 1 |
| 2 |
 ,
, .
.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
A、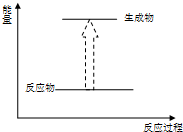 化石燃料的燃烧 |
B、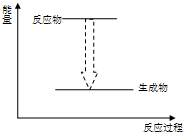 植物的光合作用 |
C、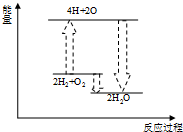 氢气与氧气反应 |
D、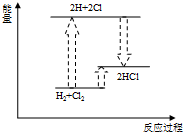 氢气与氯气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOCH2CH3+HOD→CH3COOD+CH3CH2OH |
| B、CH3COOCH2CH3+HOD→CH3COOH+CH3CH2OD |
| C、CH3CO18OCH2CH3+H2O→CH3CO18OH+CH3CH2OH |
| D、CH3C18OOC H2CH3+H2O→CH3C18OOH+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体甲一定不是SO2 |
| B、气体甲一定是Cl2 |
| C、气体甲一定不是发生了化合反应 |
| D、气体甲一定被溶液乙氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
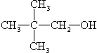
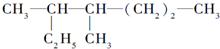 的名称是
的名称是 分子式为
分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |
 |
 |
 |
 |
 |
| 每个橡皮塞上都打了两个孔 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
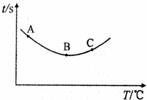 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 6 | 10 | 4 | 15 | t1 |
| ② | a | 14 | 0 | 15 | t2 |
| ③ | 6 | b | c | 25 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物属于饱和烃 |
| B、该烃的名称是3一甲基一5一乙基庚烷 |
| C、该烃与2,5一二甲基一3一乙基己烷互为同系物 |
| D、该烃的一氯取代物共有8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com