
| A、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-57.3kJ?mol-1 | ||||
| B、某酸的酸式盐NaHY水溶液显碱性,则H2Y?2H++Y2- | ||||
| C、纯碱溶液显碱性的原因用离子方程式可表示为:CO32-+2H2O?H2CO3+2OH- | ||||
D、以惰性电极电解KCl溶液的离子方程式为:2Cl-+2H2O
|
| ||


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、10℃时,粉末状锌与2mol?L-1硫酸溶液反应 |
| B、30℃时,粉末状锌与2mol?L-1硫酸溶液反应 |
| C、10℃时,块状锌与2mol?L-1硫酸溶液反应 |
| D、30℃时,块状锌与2mol?L-1硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、390.7kj/mol |
| B、-679.3kj/mol |
| C、-787kj/mol |
| D、+180.9kj/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑥ | B、②⑥ | C、①③ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油酸的分子式为C18H33O2 |
| B、油酸是乙酸的同系物 |
| C、油酸可与氢气发生加成反应 |
| D、1mol油酸最多可与1mol甘油酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
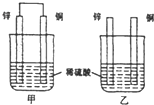 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
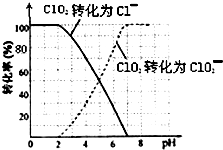 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com