
| A. | MgF2 | B. | CaCl2 | C. | K2S | D. | Na2O |
分析 B元素的最高正价和最低负价的绝对值之差为6,可知最高价为+7价,最低价为-1价,则为ⅦA族元素,因A元素和B元素原子的次外层都有8个电子,可知B为Cl元素,AB2在水溶液中电离出电子层结构相同的离子,可知A最外层由2个电子,化合价为+2价,应为Ca元素,以此解答该题.
解答 解:B元素的最高正价和最低负价的绝对值之差为6,可知最高价为+7价,最低价为-1价,则为ⅦA族元素,
因A元素和B元素原子的次外层都有8个电子,可知B为Cl元素,
AB2在水溶液中电离出电子层结构相同的离子,可知A最外层由2个电子,化合价为+2价,核外各层电子数目分别为2、8、8、2,应为Ca元素,
则AB2是CaCl2,
故选:B.
点评 本题考查原子结构与元素的性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握原子结构特点,从元素化合价的角度判断元素的种类,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
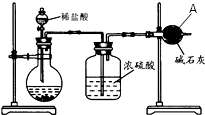 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 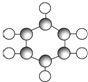 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com