
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 工业上常用电解C、D的盐溶液来制备C、D元素的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al元素,元素C在同周期的主族元素中原子半径最大,为第IA族元素,且C元素前有A、B短周期主族元素,所以C为Na元素;A、E的单质在常温下呈气态,则A为H元素,E为Cl元素,
元素B的原子最外层电子数是其电子层数的2倍,其最外层电子数为4或6,因为B原子序数小于C,所以B只能是C元素,
A.元素A、B组成的化合物为烃,常温下可能呈气态、液态或固态;
B.元素C、D、E的最高价氧化物对应的水化物分别是NaOH、Al(OH)3、HClO4,氢氧化铝是两性氢氧化物,能溶于强酸弱碱溶液;
C.C、D单质分别是Na、Al,活泼金属采用电解其熔融盐的方法冶炼;
D.AE是HCl、CE是NaCl,前者是共价化合物、后者是离子化合物.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al元素,元素C在同周期的主族元素中原子半径最大,为第IA族元素,且C元素前有A、B短周期主族元素,所以C为Na元素;A、E的单质在常温下呈气态,则A为H元素,E为Cl元素,
元素B的原子最外层电子数是其电子层数的2倍,其最外层电子数为4或6,因为B原子序数小于C,所以B只能是C元素,
A.元素A、B组成的化合物为烃,常温下可能呈气态、液态或固态,所以常温下烃不一定呈气态,故A错误;
B.元素C、D、E的最高价氧化物对应的水化物分别是NaOH、Al(OH)3、HClO4,氢氧化铝是两性氢氧化物,能溶于强酸弱碱溶液,酸碱能发生中和反应,所以元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应,故B正确;
C.C、D单质分别是Na、Al,活泼金属采用电解其熔融盐的方法冶炼,电解钠、铝的盐溶液时阴极上析出氢气而不是金属单质,故C错误;
D.AE是HCl、CE是NaCl,前者是共价化合物、后者是离子化合物,前者只含共价键、后者只含离子键,故D错误;
故选B.
点评 本题考查原子结构和元素周期律关系,为高频考点,侧重考查学生分析判断及知识综合应用能力,正确判断元素及明确物质结构和性质是解本题关键,注意金属活泼性强弱与冶炼方法的关系,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸溶液,NaAlO2溶液 | B. | 浓氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
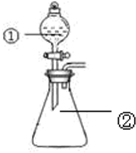 用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | SO2饱和溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是具有丁达乐效应 | |
| B. | 阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物 | |
| C. | 白磷转化为红磷是物理变化 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com