
(1)已知工业上生产H2的过程中有如下反应: CO
(g) + H2O (g) CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
|
浓度 物质 |
CO |
H2O |
CO2 |
H2 |
|
起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
|
平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
(1)①增大 ②吸热 ③8.0 1
(2)①4OH--4e-=O2+2H2O (3分) ②D ③ 阴极氢离子放电,促进水的电离,氢氧根离子浓度增大(其它各2分)
【解析】
试题分析:本题考查化学反应的限度、化学平衡及电解原理的应用。(1)①恒容增大H2O (g)的物质的量,H2O (g)的浓度增大,平衡正向移动,则CO的转化率增大;②若升高温度能使化学平衡向正反应方向移动,结合温度对化学平衡的影响规律:升温平衡向吸热方向移动,则正反应是吸热反应;③分析表中数据可知,CO的浓度变化为1.6 mol·L-1,结合反应方程式知,H2O的浓度变化也为1.6 mol·L-1,H2O的起始浓度为8.0 mol·L-1,x=8.0;将表中各物质的平衡浓度代入该反应的平衡常数表达式K=c(H2)c(CO2)/c(CO)c(H2O)计算得K=1;(2)电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,①根据题给装置图分析,左侧电极与外加电源的正极相连,作电解池的阳极,电极反应式为4OH--4e-=O2+2H2O;②右侧电极与外加电源的负极相连,作电解池的阴极,电极反应式为2H+ + 2e- = H2↑,该极区产生氢氧根,制得的氢氧化钾溶液从出口D导出;③通电开始后,阴极附近溶液pH会增大,原因是阴极氢离子放电,促进水的电离,氢氧根离子浓度增大
考点:考查化学反应的限度、化学平衡及电解原理的应用。


科目:高中化学 来源: 题型:



| ||
| △ |
| ||
| △ |
 2NH3(g);△H=-92.4kJ?mol-1
2NH3(g);△H=-92.4kJ?mol-1 2NH3(g);△H=-92.4kJ?mol-1
2NH3(g);△H=-92.4kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
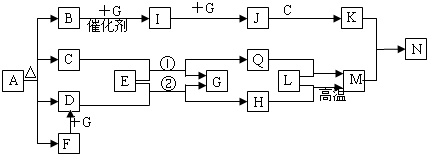
(8分)下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去)其中常温下B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,A~N的所有物质中只有G为单质,其余为化合物。N为不溶于水的无机酸。
请回答下列问题:
(1) 写出下列物质的化学式
A:_______________F:____________L:________________
(2) 写出G的一种同素异形体的化学式:
(3)已知工业上生产0.1molB放出4.62kj热量,写出该反应的热化学方程式:
(4)在反应C+E→G+F中,每生成1molG转移 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去),其中常温下C为无色液体,B、D、G、I、J为气体, 其中B可使湿润的红色石蕊试纸变蓝,A~N的所有物质中只有G为单质,其余为化合物。N为不溶于水的无机酸。
回答下列问题:
(1)A的名称为 ,E的电子式是 ;
(2)写出B + G → I的化学方程式 。
(3)写出Cu与K的稀溶液反应的离子方程式: 。
(4)写出G的一种同素异形体的化学式: ,该物质与G在化学性质上的共同点是 。
(5)已知工业上生产0.1molB放出4.62kJ热量,写出该反应的热化学方程式:
。
(6)在反应C+E→G+F中,每生成1.5 molG转移 mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com