
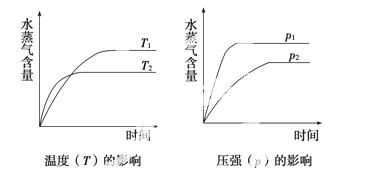
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);ΔH<0
CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g);ΔH>0
CO(g)+H2O(g);ΔH>0
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g);ΔH>0
CH2===CH2(g)+H2O(g);ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g);ΔH<0
2C6H5CH===CH2(g)+2H2O(g);ΔH<0
科目:高中化学 来源: 题型:
已知还原性 I— > Fe2+ > Br—,在只含有I—、Fe2+、Br—溶液中通入一定量的氯气,关于所得溶液离子成分分析正确的是(不考虑Br2 、I2和水的反应)( )
A.I—、Fe3+ 、Cl— B.Fe2+、Cl—、Br‑ C.Fe2+、Fe3+ 、Cl— D.Fe2+、I— 、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述错误的是
A.光导纤维和陶瓷都是硅酸盐产品
B.晶体硅可用于制造芯片
C.钢铁厂用热还原法冶炼铁
D.焙制糕点的发酵粉主要成分之一是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
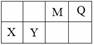
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g) 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________ mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于 m
C.在m~2m之间 D.等于2m
E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入________mol N2和________ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率增大
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
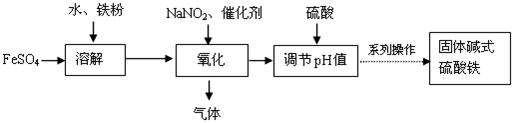
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列配制的溶液浓度偏高的是( )
配制硫酸用量筒量取硫酸时俯视刻度线
配制盐酸定容时,仰视容量瓶刻度线
NaOH溶解后未经冷却即注入容量瓶至刻度线
称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com