

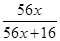 =0.75,解得x=0.86。
=0.75,解得x=0.86。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C.标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1 NA到0.2 NA之间 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3.01×1023个SO2分子的质量为32g |
| B.CH4的摩尔质量为16g |
| C.1 mol H2O的质量为18g/mol |
| D.标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3:2 | B.2:1 | C.8:1 | D.2:9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,26g乙炔含有的∏键数目为3NA |
| B.7.8gNa2O2中所含阴离子的数目是0.2NA |
| C.标准状况下,2.24Ll8O2中所含中子的数目是2NA |
| D.在密闭容器中盛有0.lmolN2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.24g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
| C.在碳酸钠溶液中,若c(CO32-)="1" mol?L-1,则c(Na+)="2" mol?L-1 |
| D.通过MnO2催化使H2O2分解,产生32gO2时转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 |
| C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023 |
| D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为 | A.120N/a | B.120a/11N | C.11a/120N | D.120N/11a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 Na2SO4+2HCl↑
Na2SO4+2HCl↑ Na2S+2CO2↑
Na2S+2CO2↑ Na2CO3+CaS
Na2CO3+CaS| x | y | z |
| | | |
| | | |
| | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com