
| A. | 恒温恒容,充入N02气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
分析 A、利用等效平衡分析,假设将充入的NO2气体放在另一个容器中建立与原平衡为等效平衡的体系,再将该体系加入到原平衡体系中,容器体积不变是,相当于加压,平衡逆向移动;
B、容器体积减小,平衡向体积减小的方向移动,混合气体的颜色与NO2的浓度成比例,据此判断;
C、根据影响平衡常数的因素判断,平衡常数只随温度变化;
D、化学反应速率之比等于化学方程式计量数之比为正反应速率之比.
解答 解:A、假设将充入的NO2气体放在另一个容器中建立与原平衡为等效平衡的体系,再将该体系加入到原平衡体系中,容器体积不变是,相当于加压,平衡逆向移动,NO2气体的转化率减小,故A错误;
B、因为该反应是体积增大的反应,容器体积减小,平衡逆向移动,NO2的浓度增大,体积减小,所有物质的浓度也都会增大,所以混合气体的颜色会加深,故B正确;
C、平衡常数只受温度影响,与压强无关,故C错误;
D、当v正(NO)═2v逆(O2),反应达到化学平衡,当2v正(NO)=v逆(O2)时不能说明反应达到平衡状态,故D错误;
故选B.
点评 本题主要考查了影响化学平衡移动的因素、等效平衡的思想、影响平衡常数的因素及平衡状态的判断等知识点,中等难度,解题时注意化学原理知识的灵活运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:实验题
(1)欲验证某溶液中含有较大量的Cl-、CO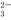 、S
、S O
O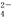 三种离子,如果只取一次该溶
三种离子,如果只取一次该溶 液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
(2)溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序写出对应的离子方程式_______________、_______________、________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列有关物质用途的说法中,不正确的是
A.液氨常用作制冷剂 B.硅可用来制造半导体材料
C.CuO常用于制造红色油漆 D.铝合金可用于制造门窗
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
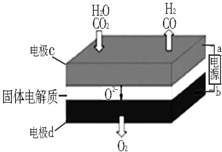 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 及时除去二氧化碳,正反应速率加快 | |
| B. | 其它条件不变,加入催化剂,△H变大 | |
| C. | 增大压强,正反应速率增大,逆反应速率减小 | |
| D. | 降低温度,可提高反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
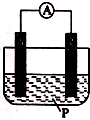 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 锌 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com