
【题目】根据题意填空:
(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: .
(2)下表是几种常见弱酸的电离平衡常数(25℃)
酸 | H2CO3 | CH3COOH | HClO |
K | K1=4.4×10﹣7;K 2=4.7×10﹣11 | K=1.76×10﹣5 | K=2.95×10﹣8 |
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是 .
(3)常温下,将0.02molL﹣1 的 Ba(OH)2溶液100mL和0.02molL﹣1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为 .
(4)25℃时,Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[MgF2]=7.42×10﹣11 . 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,(填化学式)溶液中的 c(Mg2+)大.
【答案】
(1)c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
(2)CH3COOH>H2CO3>HClO; NaAc<NaClO<Na2CO3
(3)12
(4)MgF2
【解析】解:(1)碳酸钠溶液中碳酸根离子分步水解溶液显碱性,离子浓度大小为:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+),
所以答案是:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+);(2)电离平衡常数越大酸性越强,图表中可知:电离平衡常数CH3COOH>H2CO3>HClO>HCO3﹣,酸性越弱对应盐水解程度越大,对应盐的水解程度Na2CO3>NaClO>NaAc,
所以答案是:CH3COOH>H2CO3>HClO;NaAc<NaClO<Na2CO3;(3)100mL 0.02molL﹣1的Ba(OH)2溶液中氢氧化钡物质的量为:0.02molL﹣1×0.1L=0.002mol,氢氧根的物质的量为0.004mol;
100mL 0.02molL﹣1的NaHSO4溶液中硫酸氢钠的物质的量为:0.02molL﹣1×0.1L=0.002mol,氢离子的物质的量为:0.002mol;
A.两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为: ![]() =0.01mol/L,溶液的pH=12
=0.01mol/L,溶液的pH=12
所以答案是:12;(4)因氢氧化镁溶度积小,由Ksp计算则其Mg2+浓度小,该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2溶液中的 c(Mg2+)大,
所以答案是:MgF2.


科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的微量元素的说法不正确的是( )
A. Cu、Zn、Mo等是细胞内的微量元素
B. 生物体中可以有、也可以没有的一些元素
C. 微量元素是维持正常生命活动不可缺少的元素
D. 指生物生活所必需的,但需要量却很少的一些元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已知反应 NaNO2+HF═HNO2+NaF,7.2×10﹣4、4.6×10﹣4分别是上式所涉及的两种酸的电离常数.由此可判断下列叙述中不正确的是( )
A.K(HF)=c(F﹣)c(H+)/c(HF )
B.K(HNO2)=7.2×10﹣4
C.酸性强弱为 HF>HNO2
D.K(HNO2)<K(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( ) 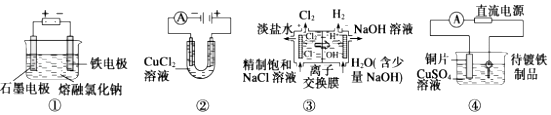
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属
B.装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝
C.装置③中的离子交换膜允许阳离子、阴离子和小分子水通过
D.装置④的待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器内发生反应N2(g)+3H2(g)![]() 2NH3(g),不可能为平衡状态的是( )
2NH3(g),不可能为平衡状态的是( )
A. NH3、N2、H2的物质的量都不再改变
B. NH3、N2、H2的体积分数都不再改变
C. 混合气体平均相对分子质量不再改变
D. 一个N≡N断裂的同时,有3个H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
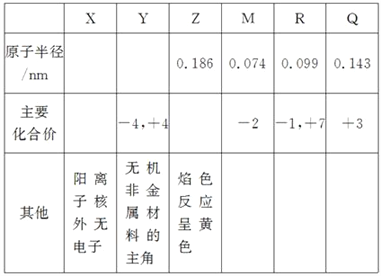
(1)R在元素周期表中的位置是________;R在自然界中有质量数为35和37的两种核素,它们之间的关系为______________________。
(2)Z的单质与水反应的化学方程式为______________________。
(3)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是________________________。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:XR>YX4
c.最高价氧化物对应的水化物的酸性:HRO4>H2YO3
(4)根据表中数据推测Y的原子半径的范围:________nm<rY<________nm。___________________
(5)甲、乙是上述部分元素的最高价氧化物对应的水化物,且甲+乙―→丙+水,则丙的化学式为________________________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×l0-3)制备FePO4流程如下:

(1)“溶解”时H3PO4不宜过量太多的原因是___。
(2)①写出“反应”时总反应的离子方程式:____。
②证明“反应”后铁元素沉淀完全的实验方法是___。
(3)①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是____。
②洗涤FePO4沉淀的操作是 ___。
(4)FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近l00℃时易失去结晶水。相关物质的溶解度曲线如图所示。
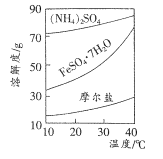
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入____。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A: ①由C、H、O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%
②如图是该有机物的质谱图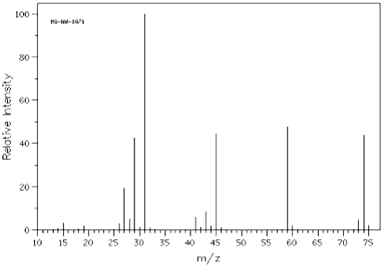
③A的红外光谱图上有C﹣H键、O﹣H键、C﹣O键的振动吸收峰.
④A的核磁共振氢谱有两个峰.请回答:
(1)A的实验式(最简式)为 , 相对分子质量为 , 分子式为 .
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”) , 为什么 .
(3)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

(1)实验时放出气体的总体积是_______________________________________。
(2)放出一半气体所需的时间为_________________________________________。
(3)反应放出3/4气体所需时间为_________________________________________________。
(4)A、B、C、D各点反应速率快慢的顺序为________________________________________。
(5)解释反应速率变化的原因是_______________________________________________。
(6)计算H2O2的初始物质的量的浓度________________________________________。
(7)求反应到2 min时,H2O2的质量分数_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com