
【题目】下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C.点燃的镁条不能在二氧化碳气体中继续燃烧
D.含0.2molH2SO4的硫酸与足量的铜反应,生成标准状况下的气体2.24L
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有CO,另一个盛有N2和C2H4,在同温同压下两容器内的气体一定具有相同:①.原子总数 ②.质子总数 ③.分子总数 ④.质量
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是


A. 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能与电能相互转化的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;G能与NaHCO3溶液反应放出CO2气体。
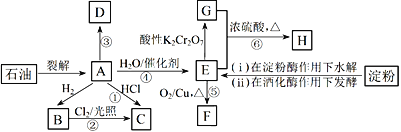
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。
反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
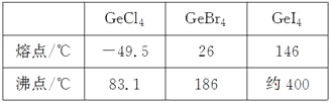
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。
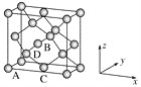
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn- 的化学式为( )
A.I2O94-B.I2O106-C.I2O118-D.I2O1210-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整 (SPG) | C3H8O3(1)+3H2O(g) | 反应I |
甘油部分氧化 (POG) | C3H8O3(1)+ | 反应II |
甘油氧化水蒸气 重整(OSRG) | C3H8O3(1)+ | 反应III |
(1)下列说法正确的是________(填字母序号)。
a. 消耗等量的甘油,反应I的产氢率最高
b. 消耗等量的甘油,反应Ⅱ的放热最显著
c. 经过计算得到反应Ⅲ的 △H3=-237.5 kJ·mol-1
d. 理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热反应和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应Ⅲ设定在较高温度(600~700℃)进行,选择该温度范围的原因有:催化剂活性和选择性高、__________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO,CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:___________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:__________。

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是_________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2![]() La2O/span>2CO3
La2O/span>2CO3
第二步为:__________(写出化学反应方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com