
【题目】下列关于2 mol氧气的叙述中,正确的是
A. 质量是32 g B. 体积是44.8 L
C. 分子数约为1.204×1024 D. 原子数是2 mol
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】胶体是一种常见的分散系。下列事实与胶体的性质无关的是
A. 明矾净水
B. 清晨森林中看到的一缕缕光束
C. 盐酸与硝酸银溶液反应生成白色沉淀
D. 一束平行光射入蛋白质溶液中,从侧面可以看到一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
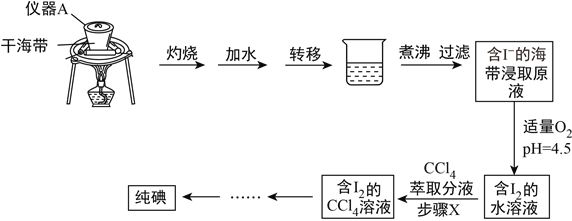
(1)仪器A的名称为__________________,实验室取用仪器A必须使用_________。
(2)煮沸的作用是______________________。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是__________;萃取后,分液漏斗内观察到的现象是___________;分液时,为了保证液体顺利留下,应首先_________。
(4)向海带浸取原液中通入适量O2,并控制溶液pH为4.5,此时发生反应的离子反应方程式为:__________________________________________。
(5)某同学欲采用蒸馏含I2的CCl4溶液得到纯碘,此方案不合理,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1L某溶液中含有0.1molKCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度为
A. 3mol/L B. 0.2mol/L C. 0.3mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
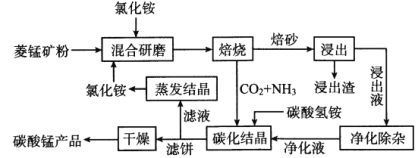
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
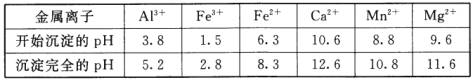
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_________。
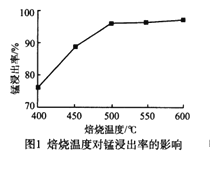
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度为500℃的原因_________________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中![]() =_________。
=_________。
(3)碳化结晶时,反应的离子方程式为_________。
(4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃—770℃范围内,发生反应的化学方程式为________________________。
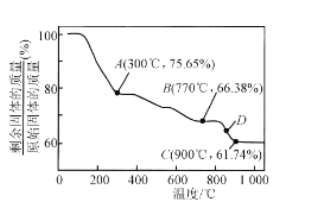
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质在熔融态下能导电,则该物质中一定含有离子键
B. ![]() 中既有离子键又有共价键,所以
中既有离子键又有共价键,所以![]() 属于离子化合物
属于离子化合物
C. ![]() 和
和![]() 两种分子中,每个原子的最外层都具有8电子稳定结构
两种分子中,每个原子的最外层都具有8电子稳定结构
D. 二氧化硅和干冰都是共价化合物,其溶于水的过程中均只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下,下列有关说法正确的是
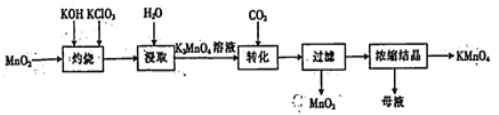
A. “灼烧”时,可在瓷坩埚中进行
B. “浸取”时,可用无水乙醇代替水
C. “转化”反应中,生成的KMnO4与MnO2的物质的量之比为1:2
D. “浓缩结晶”后的母液中仍可能含有KMnO4和K2CO3两种溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com