
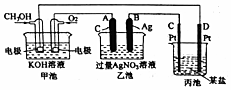
分析 燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e-+2H2O=4OH-,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极氢氧根放电产生氧气,阴极银离子放电产生银,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电,据此分析解答.
解答 解:燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e-+2H2O=4OH-,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极、阴极电极反应分别为4OH--4e-=O2↑+2H2O、Ag++e-=Ag,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电.
(1)通入O2的电极是正极,C(Pt)电极的名称是阳极,故答案为:正极;阳极;
(2)通入O2的电极上的电极反应式是O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(3)燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH--6e-═CO32-+6H2O,故答案为:CH3OH+8OH--6e-═CO32-+6H2O;
(4)丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氯离子在阳极失电子产生氯气,电极反应为:2Cl--2e-=Cl2↑,氢离子在阴极得到电子产生氢气,电极反应为:2H++2e-=H2↑,水的电离平衡被破坏,氢氧根离子的浓度增大,该区域溶液呈碱性,滴入酚酞溶液变红,
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;阴极;
(5)乙池中A是阳极、B是阴极,阳极水电离出的氢氧根失电子产生氧气,阴极银离子得电子产生单质银,属于放氧生酸型,电解反应的化学方程式为:2H2O+4AgNO3$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,故答案为:2H2O+4AgNO3$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
(6)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e-=Ag,转移电子为:$\frac{5.40g}{108g/mol}$=0.05mol,根据O2+4e-+2H2O=4OH-,甲池中理论上消耗O2的体积是:$\frac{0.05mol}{4}$×22.4L/mol=0.28L=280mL,产生氢氧根的物质的量为:0.05mol,c(OH-)=$\frac{n}{V}$=$\frac{0.05mol}{0.5L}$=0.1mol/L,则溶液PH=13,
故答案为:280;13.
点评 本题考查了原电池和电解池原理,涉及电极的判断及电极反应式的书写,再结合转移电子相等进行计算,考查学生综合运用知识的能力,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等体积的CO与CO2中所含碳原子数之比为1:1 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | pH=4 时,醋酸的电离常数Ka≈1.8×10-5 | |
| B. | B点时,c(CH3COOˉ)=c(CH3COOH) | |
| C. | B点时,在溶液中滴入酚酞试剂,溶液显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶 | B. | 量筒 | C. | 碱式滴定管 | D. | 以上仪器均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量为71 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 0.012kg12C中所含的原子数称为阿伏加德罗常数 | |
| D. | 卢瑟福根据α粒子散射实验,提出了带核的原子结构模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com