
下列化学用语描述正确的是( )
A.NH4I的电子式: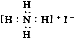
B.漂白粉、石英都属于纯净物
C.烧碱、冰醋酸、干冰、胆矾均为电解质
D.C60、C70、金刚石、石墨均为碳的同素异形体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:选择题
化学与生活密切联系,下列与盐类水解无关的是
A.实验室配制FeCl3溶液时,应先将其溶解在盐酸中,而后加水稀释
B.实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
C.用NaHCO3粉末作灭火剂
D.加热蒸干A1C13溶液得到A1(OH)3固体
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是( )
A.pH=7的氨水与氯化铵的混合溶液中:[Cl-]>[NH4+]
B.25℃时pH=2的一元酸和pH=12的一元强碱等体积混合:[OH-]=[H+]
C.0.1mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:选择题
一定质量的铜分别与足量的稀硝酸或浓硝酸完全反应,在相同条件下,用排水集气法收集产生的气体(假设产物气体只可能是NO或NO2).下列叙述一定正确的是( )
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Cu(NO3)2的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同.
A.只有② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江、吉林省两省六校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列实验操作不正确的是的是( )
A. NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
B. 除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出
D. 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用500mL容量瓶配制两次
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:实验题
已知:在常温下,苯(C6H6)为一种无色、透明的液体,毒性较高,易挥发,易燃,有腐蚀性,沸点为80.1℃,难溶于水,易溶于有机溶剂,可作为有机溶剂;碘(I2)为紫黑色晶体,易升华,易凝华,熔点113.5℃,沸点184.3℃,加热时碘升华为紫色蒸气,冷却后凝华成紫黑色固体。实验室常用苯来提取碘水中的碘,具体操作如下:
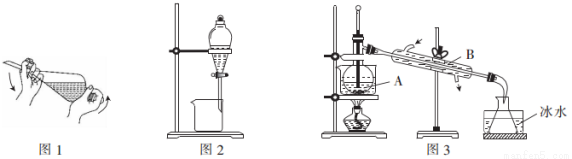
①向碘的水溶液中加入萃取剂苯,转移到分液漏斗中,塞上玻璃塞,充分振荡放气后(如图1);
②将分液漏斗置于铁架台的铁圈上静置(如图2);
③当分液漏斗中的液体分成清晰的两层后,经“合适的操作”将两层液体进行分离;
④将分离出的碘和苯的混合液转移到仪器A中,加入少量沸石进行蒸馏以分离苯和碘(如图3)。
请回答下列问题:
(1)分液漏斗在使用前必须进行的操作是_______;振荡静置后溶有碘的苯溶液在分液漏斗的_____(填“上层”或“下层”)。
(2)步骤③中“合适的操作”的名称是________。
(3)步骤④中采用水浴加热而不直接加热的原因是________________;图3中仪器A的名称是______;图3中有多处明显的错误:a.冷却水进出方向错误.b.____________;C.___________。
(4)锥形瓶置于冰水中的目的是____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
下列物质在水中的电离方程式书写正确的是
A.NaHSO4 =Na++HSO4- B.NaHCO3 =Na++H++CO32-
C.KClO3 =K++Cl-+3O2- D.Al2(SO4)3 =2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
下列物质中,其水溶液能导电又属于非电解质的是
A.NH3 B.蔗糖 C.空气 D.液态HC1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:填空题
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1 △H1<0(I)
2NO(g)+Cl2(g)?2ClNO(g) K2 △H2<0(II)
(1)4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K3 △H3
K3 = (用K1、K2表示)(K1、K2、K3均为平衡常数)
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入 0.2mol的NO和0.1mol的 Cl2,10min时反应(II)达到平衡。测得10min内 V(ClNO)= 7.5×10—3mol/(L•min),则平衡后 n(Cl2)= mol,NO的转化率a1= 。 其他条件不变,反应(II)在恒压条件下进行,平衡时NO的转化率a2 a1(填“>”、“<”或“=”), 平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采取的措施是__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为 2NO2 + 2 NaOH = NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与 0.2mol NO2恰好完全反应得 1L溶液A,溶液B 为 0.1mol/L的CH3COONa溶液,则两溶液中 c(NO3—)、c(NO2—)、和c(CH3COO—)由大到小的顺序为______________________(已知 HNO2的电离常数为 Ka= 7.1×10—4mol/L,CH3COOH的电离常数为 Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是
Ka= 1.7×10—5 mol/L )可使溶液A和溶液B的PH相等的方法是
A、向溶液A中加适量水 B、向溶液A中加适量Na OH
OH
C、向溶液B中加适量水 D、向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com