
| A. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀H2SO4洗净并灼烧 | |
| B. | 制备氢氧化铜悬浊液时,向10%NaOH溶液中滴入少量2%CuSO4溶液 | |
| C. | 配制浓H2SO4、浓HNO3混合酸时,首先向试管里放入一定量浓H2SO4 | |
| D. | 纸层析实验中,将试液点滴浸没在展开剂里,静置观察 |
分析 A.稀H2SO4不挥发,干扰实验;
B.向10%NaOH溶液中滴入少量2%CuSO4溶液,NaOH过量;
C.配制浓H2SO4、浓HNO3混合酸时,类似浓硫酸的稀释,先加硝酸;
D.试液点与展开剂不能接触.
解答 解:A.稀H2SO4不挥发,干扰实验,应选稀盐酸洗净并灼烧,故A错误;
B.向10%NaOH溶液中滴入少量2%CuSO4溶液,NaOH过量,则可制备氢氧化铜悬浊液时,故B正确;
C.配制浓H2SO4、浓HNO3混合酸时,类似浓硫酸的稀释,先加硝酸,然后向试管里放入一定量浓H2SO4,故C错误;
D.纸层析实验中,滤纸上的试样点是不可以浸入展开剂中的,否则试样会溶解在展开剂中,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及焰色反应、物质的制备、实验基本操作等,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
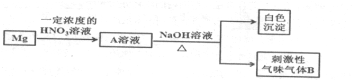
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
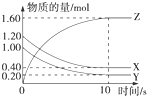 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱吸收硫酸工业的尾气 | B. | 用烧碱吸收氯碱工业的尾气 | ||
| C. | 用纯碱吸收合成氨工业的尾气 | D. | 用烧碱吸收炼铁工业的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
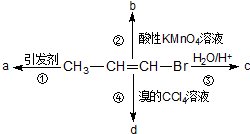 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
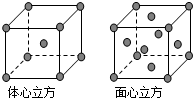 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com