
【题目】金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是( )
A.越活泼的金属越难冶炼
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Al都是用电解其熔融的氯化物制得的
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述中正确的是
A. 该溶液呈电中性
B. 它与H2S反应的离子方程式为:Cu2++S2-=CuS↓
C. 用惰性电极电解该溶液时,阳极产生铜单质
D. 在溶液中:c (Cu2+) +c (H+)=c(SO42-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
钒(12V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒价层电子排布图为 ,比钒质子数大1的元素原子的电子排布式为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的转化剂。SO2分子VSEPR模型是 ,硫原子杂化类型为 ;SO3气态为单分子,SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S——O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为 (填图2字母),该分子含有 个σ键。
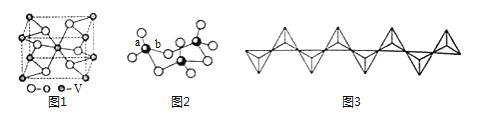
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(钒位于体心),则偏钒酸钠的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种物质的溶解曲线如图所示。下列说法正确的是
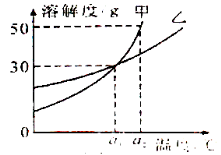
A. a1℃时甲和乙的饱和溶液,升温到a2 ℃时仍是饱和溶液
B.甲和乙的溶解度相等
C.a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液
D. a2℃时,在100g水中加入60g甲,形成不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
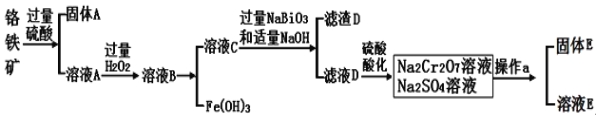
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
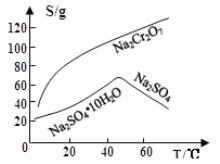
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
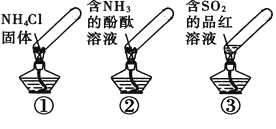
A. 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②溶液褪色或红色变浅,冷却后又都变为红色
C. 加热时,③溶液褪色或红色变浅,冷却后又都变为红色
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 = 2KSCN + CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO![]() 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 ![]() NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是 ( )
A.酸性(水溶液):HSCN > H2CO3 > HCN
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)![]() 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是

A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com