
| A. | 若酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的某二元弱酸盐Na2A溶液中,c(Na+)═2[c(HA-)+c(A2-)+c(H2A)] |
分析 A、根据酸越弱,对应的盐溶液水解程度越大分析;
B、NaOH为强碱,一水合氨为弱碱,稀释相同倍数时,强碱的pH变化大;
C、醋酸是弱酸,NaOH是强碱,氢离子浓度与氢氧根离子浓度相同时,醋酸浓度大于NaOH浓度;
D、H2A是二元弱酸,Na2A能够分步水解生成HA-和H2A,据物料守恒分析.
解答 解:A、酸越弱,对应的盐溶液水解程度越大,则若酸性HA>HB,则钠盐溶液的碱性NaA<NaB,故A错误;
B、NaOH为强碱,一水合氨为弱碱,加水稀释使其pH变化相同倍数时,一水合氨加水的体积大,故B错误;
C、pH=3的醋酸与pH=11的NaOH溶液等体积混合时溶液显酸性,所以溶液中离子浓度的大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、在二元弱酸盐Na2A溶液中,Na2A能够分步水解生成HA-和H2A,据物料守恒可知c(Na+)═2[c(HA-)+c(A2-)+c(H2A)],故D正确;
故选D.
点评 本题考查了盐类水解、强弱电解质的区别、离子浓度大小的比较、电解质溶液中的物料守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO32- | D. | 可能会有SO42-或Ag+或SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
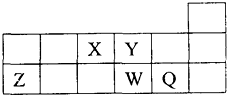
| A. | 离子Y2一和Z3+的核外电子数和核内质子数都相同 | |
| B. | 原子半径的大小顺序为:r(Z)>r(W)>r(Q)>r(Y)>r(X) | |
| C. | 最高价氧化物对应的水化物的酸性:W>Q | |
| D. | 元素X与元素Z的最高正化合价数值之和等于8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比PH3稳定 | |
| B. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 某元素原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com